Không dùng thêm thuốc thử hãy trình bày cách phân biệt các chất chứa trong các lọ riêng biệt bị mất nhãn sau: MgCl2,NaOH,NH4Cl,BaCl2,H2SO4. Viết các PTHH

Những câu hỏi liên quan
Bài 14. Phân biệt các dung dịch chứa trong các lọ bị mất nhãn sau chỉ bằng dung dịch phenol phtalein: Na2SO4, H2SO4, BaCl2, NaOH, MgCl2.Bài 15: Không được dùng thêm thuốc thử nào khác, hãy nhận biết các dung dịch bằng phương pháp hoá học.a) Na2CO3, HCl, BaCl2b) HCl, H2SO4, Na2CO3, BaCl2c) MgCl2, NaOH, NH4Cl, BaCl2, H2SO4Bài 16: Hãy phân biệt các chất sau chứa trong các lọ bị mất nhãn mà không dùng thuốc thử nào: NaHCO3, HCl, Ba(HCO3)2, MgCl2, NaCl.Bài 17: Có 4 lọ mất nhãn đựng 4 dung dịch HCl,...
Đọc tiếp
Bài 14. Phân biệt các dung dịch chứa trong các lọ bị mất nhãn sau chỉ bằng dung dịch phenol phtalein: Na2SO4, H2SO4, BaCl2, NaOH, MgCl2.
Bài 15: Không được dùng thêm thuốc thử nào khác, hãy nhận biết các dung dịch bằng phương pháp hoá học.
a) Na2CO3, HCl, BaCl2
b) HCl, H2SO4, Na2CO3, BaCl2
c) MgCl2, NaOH, NH4Cl, BaCl2, H2SO4
Bài 16: Hãy phân biệt các chất sau chứa trong các lọ bị mất nhãn mà không dùng thuốc thử nào: NaHCO3, HCl, Ba(HCO3)2, MgCl2, NaCl.
Bài 17: Có 4 lọ mất nhãn đựng 4 dung dịch HCl, H2SO4, BaCl2, Na2CO3. Hãy phân biệt các dung dịch mà không dùng bất kỳ thuốc thử nào.
Bài 18: Không được dùng thêm thuốc thử , hãy phân biệt 3 dung dịch chứa trong 3 lọ mất nhãn: NaCl, AlCl3, NaOH.
Bài 19. Trình bày phương pháp phân biệt các dung dịch chứa trong các lọ bị mất nhãn sau mà không dùng thuốc thử nào:
a. HCl, AgNO3, Na2CO3, CaCl2.
b.HCl, H2SO4, BaCl2, Na2CO3.
Bài 20. Không dùng thuốc thử hãy phân biệt các chất sau chứa trong các lọ riêng biệt bị mất nhãn: NaOH, NH4Cl, BaCl2, MgCl2, H2SO4.
Từ bài 16 các bạn tham khảo để làm sau.
Trình bày phương pháp hóa học nhận biết các dung dịch: Ba(OH)2, BaCl2, NaOH, NaCl, H2SO4, HCl đựng trong các lọ riêng biệt bị mất nhãn chỉ bằng một thuốc thử là quỳ tím.
- Lấy mỗi chất một ít làm mẫu thử và đánh STT.
- Nhúng quỳ tím vao các mẫu thử.
+ Mẫu làm quỳ hóa đỏ: HCl, H2SO4
+ Mẫu làm quỳ hóa xanh: Ba(OH)2, NaOH
+ Mẫu không làm quỳ đổi màu: NaCl, BaCl2
- Lấy một trong 2 axit cho tác dụng với muối:
TH1: Trong các mẫu muối không phản ứng => Axit đã dùng là HCl => Axit còn lại là H2SO4.
Cho axit H2SO4 tác dụng với muối.
+ Mẫu không phản ứng: NaCl
+ Mẫu phản ứng, tạo kết tủa trắng: BaCl2
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Cho axit H2SO4 tác dụng với các bazo.
+ Mẫu phản ứng nhưng không có hiện tượng đặc trưng: NaOH
+ Mẫu phản ứng, tạo kết tủa trắng: Ba(OH)2
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
TH2: Trong các mẫu muối có một mẫu phản ứng, tạo kết tủa trắng => Mẫu muối đó là BaCl2 => Mẫu muối còn lại là NaCl, mẫu axit đã dùng là H2SO4 => Mẫu axit còn lại là HCl. (Phương trình tương tự bên trên)
Tương tự cho axit H2SO4 tác dụng với bazo như trên để nhận biết 2 bazo còn lại.
Đúng 1
Bình luận (0)
Có các hóa chất sau đựng riêng biệt trong các lọ mất nhãn: KCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Thuốc thử có thể dùng để nhận biết các hóa chất trên là A. NaOH B. Ba(OH)2 C. Ba(NO3) D. AgNO3
Đọc tiếp
Có các hóa chất sau đựng riêng biệt trong các lọ mất nhãn: KCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Thuốc thử có thể dùng để nhận biết các hóa chất trên là
A. NaOH
B. Ba(OH)2
C. Ba(NO3)
D. AgNO3
Đáp án B
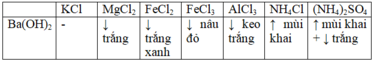
MgCl2 +Ba(OH)2 →Mg(OH)2 + BaCl2
FeCl2 +Ba(OH)2 →Fe(OH)2 + BaCl2
2FeCl3 +3Ba(OH)2 →2Fe(OH)3 + 3BaCl2
2AlCl3 +3Ba(OH)2 →2Al(OH)3 + 3BaCl2
2NH4Cl + Ba(OH)2 → 2NH3 + 2H2O + BaCl2
(NH4)2SO4 + Ba(OH)2 →2NH3 + 2H2O + BaSO4
Đúng 1
Bình luận (0)
Câu 1. Chỉ được dùng quỳ tím hãy phân biệt 3 dung dịch không màu dụng trong các lọ mất nhãn sau: BaCl2, HCL, H2SO4.
Câu 2. Chỉ được dùng thêm quý tím, trình bày phương pháp hóa học để phân biệt 3 dung dịch không máu chứa riêng biệt trong 3 ống nghiệm: Ba(OH)2, HCI, H2SO4.
Câu 3. Hãy chọn chất thích hợp diễn vào chỗ (. . . . .) và hoàn thành các phương trình hóa học sau:
a) ............ + FeS2 ➡ SO2 + .........
b) HCl + ......... ➡ AgCl + ............
Đọc tiếp
Câu 1. Chỉ được dùng quỳ tím hãy phân biệt 3 dung dịch không màu dụng trong các lọ mất nhãn sau: BaCl2, HCL, H2SO4. Câu 2. Chỉ được dùng thêm quý tím, trình bày phương pháp hóa học để phân biệt 3 dung dịch không máu chứa riêng biệt trong 3 ống nghiệm: Ba(OH)2, HCI, H2SO4. Câu 3. Hãy chọn chất thích hợp diễn vào chỗ (. . . . .) và hoàn thành các phương trình hóa học sau: a) ............ + FeS2 ➡ SO2 + ......... b) HCl + ......... ➡ AgCl + ........... c) NaCl + ......... ➡ NaOH + Cl2 + ........... d)NaOH + ....... ➡ NaCl + ................ e) Cu + .......... ➡ CuSO4 + SO2 +H2O Câu 4. Viết phương trình hóa học của phản ứng xảy ra để thực hiện chuỗi biến hóa sau: Na ➡(1) Na2O ➡(2) Na2CO3 ➡(3) Na2SO4 ➡(4) NaCl ➡ (5) NaOH. Câu 5. Viết phương trình hóa học của phản ứng xảy ra để thực hiện chuỗi biến hóa sau: S ➡(1) SO2 ➡(2) SO3 ➡ (3) H2SO4 ➡ (4) SO2 ➡ (5) Na2SO3. Câu 6. Hoà tan 5,6 gam Iron (Fe) trong m gam dung dịch HCl 3,65% vừa đủ để sinh ra khí Hydrogen ở điều kiện chuẩn. a)Tính thể tích khi sinh ra ở điều kiện chuẩn. b) Tính m gam. c)Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng. Câu 7. Cho 63,6g hỗn hợp hai chất CaSO3 và CaO vào dung dịch acid HCI Kết thúc phản ứng thu được 7,437lít khí (đkc) thoát ra. Hãy tính: a ) Khối lượng mỗi chất có trong hỗn hợp ban đầu. b) Khối lượng dung dịch HCl 20% cần dùng vừa đủ cho phản ứng trên. Câu 8. Cho 41,2g hỗn hợp hai chất CaCO3, và CaO vào dung dịch acid HNO3 Kết thúc phản ứng thu được 7,437 lít khí (dkc) thoát ra. Hãy tính: a)Khối lượng mỗi chất có trong hỗn hợp ban đầu b ) Khối lượng dung dịch HNO3, 10,5% cần dùng vừa đủ cho phản ứng trên.
Câu 1. Chỉ được dùng quỳ tím hãy phân biệt 3 dung dịch không màu dụng trong các lọ mất nhãn sau: BaCl2, HCL, H2SO4.Câu 2. Chỉ được dùng thêm quý tím, trình bày phương pháp hóa học để phân biệt 3 dung dịch không máu chứa riêng biệt trong 3 ống nghiệm: Ba(OH)2, HCI, H2SO4.Câu 3. Hãy chọn chất thích hợp diễn vào chỗ (. . . . .) và hoàn thành các phương trình hóa học sau:a) ............ + FeS2 ➡ SO2 + .........b) HCl + ......... ➡ AgCl + ...........c) NaCl + ......... ➡ NaOH + Cl2 + ...........d)NaO...
Đọc tiếp
Câu 1. Chỉ được dùng quỳ tím hãy phân biệt 3 dung dịch không màu dụng trong các lọ mất nhãn sau: BaCl2, HCL, H2SO4.
Câu 2. Chỉ được dùng thêm quý tím, trình bày phương pháp hóa học để phân biệt 3 dung dịch không máu chứa riêng biệt trong 3 ống nghiệm: Ba(OH)2, HCI, H2SO4.
Câu 3. Hãy chọn chất thích hợp diễn vào chỗ (. . . . .) và hoàn thành các phương trình hóa học sau:
a) ............ + FeS2 ➡ SO2 + .........
b) HCl + ......... ➡ AgCl + ...........
c) NaCl + ......... ➡ NaOH + Cl2 + ...........
d)NaOH + ....... ➡ NaCl + ................
e) Cu + .......... ➡ CuSO4 + SO2 +H2O
Câu 4. Viết phương trình hóa học của phản ứng xảy ra để thực hiện chuỗi biến hóa sau:
\(Na\underrightarrow{\left(1\right)}Na_2O\underrightarrow{\left(2\right)}Na_2CO_3\underrightarrow{\left(3\right)}Na_2SO_4\underrightarrow{\left(4\right)}NaCl\underrightarrow{\left(5\right)}NaOH\)
Câu 5. Viết phương trình hóa học của phản ứng xảy ra để thực hiện chuỗi biến hóa sau:
S ➡(1) SO2 ➡(2) SO3 ➡ (3) H2SO4 ➡ (4) SO2 ➡ (5) Na2SO3.
Câu 6. Hoà tan 5,6 gam Iron (Fe) trong m gam dung dịch HCl 3,65% vừa đủ để sinh ra khí Hydrogen ở điều kiện chuẩn.
a)Tính thể tích khi sinh ra ở điều kiện chuẩn.
b) Tính m gam.
c)Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
Câu 7. Cho 63,6g hỗn hợp hai chất CaSO3 và CaO vào dung dịch acid HCI Kết thúc phản ứng thu được 7,437lít khí (đkc) thoát ra. Hãy tính:
a ) Khối lượng mỗi chất có trong hỗn hợp ban đầu.
b) Khối lượng dung dịch HCl 20% cần dùng vừa đủ cho phản ứng trên.
Câu 8. Cho 41,2g hỗn hợp hai chất CaCO3, và CaO vào dung dịch acid HNO3 .Kết thúc phản ứng thu được 7,437 lít khí (dkc) thoát ra. Hãy tính:
a)Khối lượng mỗi chất có trong hỗn hợp ban đầu
b ) Khối lượng dung dịch HNO3, 10,5% cần dùng vừa đủ cho phản ứng trên.
câu 9. trình bày phương trình hóa học để phân biệt 3 dung dịch khôg màu chứa riêng biệt trong 3 ống nghiệm: Na2SO4, HCl, H2SO4
Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: M g C l 2 , K B r , H C l . Viết phương trình hóa học xảy ra.
Không dùng thêm bất kì thuốc thử nào hãy nhận biết 5 lọ mất nhãn đựng các dung dịch sau NaOH, MgCl2, Al2(SO4)3,H2SO4,BaCl2
- Dùng một ít các dung dịch làm mẫu thử
- Cho các dd tác dụng với nhau, ta có bảng:
| NaOH | MgCl2 | Al2(SO4)3 | H2SO4 | BaCl2 | |
| NaOH | - | kết tủa trắng, không tan
| kết tủa trắng, tan dần vào dd | - | - |
| MgCl2 | kết tủa trắng, không tan
| - | - | - | - |
| Al2(SO4)3 | kết tủa trắng, tan dần vào dd | - | - | - | kết tủa trắng, không tan |
| H2SO4 | - | - | - | - | kết tủa trắng, không tan |
| BaCl2 | - | - | kết tủa trắng, không tan | kết tủa trắng, không tan | - |
- Kết quả:
+ Chất có xuất hiện 1 kết tủa trắng không tan và 1 kết tủa trắng có tan trong dd: NaOH, Al2(SO4)3 (1)
+ Chất có xuất hiện 1 kết tủa trắng không tan: MgCl2, H2SO4 (2)
+ Chất có xuất hiện 2 kết tủa trắng không tan: BaCl2
- Cho dd BaCl2 tác dụng với 2 dd ở (1)
+ Kết tủa trắng: Al2(SO4)3
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4\downarrow+2AlCl_3\)
+ Không hiện tượng: NaOH
- Cho dd BaCl2 tác dụng với 2 dd ở (2)
+ Kết tủa trắng: H2SO4
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
+ Không hiện tượng: MgCl2
\(2NaOH+MgCl_2\rightarrow2NaCl+Mg\left(OH\right)_2\downarrow\)
\(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\downarrow\)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4\downarrow+2AlCl_3\)
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
Đúng 2
Bình luận (0)
Có các lọ mất nhãn đựng riêng biệt các chất rắn sau: CaCO3, K2CO3, NaHCO3, KCl. Trình bày cách phân biệt các lọ trên bằng phương pháp hoá học.
Có các lọ mất nhãn đựng riêng biệt các dung dịch sau: Na2CO3, NaOH, Ca(OH)2, HCl. Không dùng quỳ tím, hãy phân biệt các lọ này bằng phương pháp hoá học.
1. - Trích mẫu thử.
- Hòa tan từng mẫu thử vào nước.
+ Tan: K2CO3, KHCO3 và KCl. (1)
+ Không tan: CaCO3.
- Cho dd mẫu thử nhóm (1) pư với HCl dư.
+ Có khí thoát ra: K2CO3, KHCO3. (2)
PT: \(K_2CO_3+2HCl\rightarrow2KCl+CO_2+H_2O\)
\(KHCO_3+HCl\rightarrow KCl+CO_2+H_2O\)
+ Không hiện tượng: KCl.
- Cho mẫu thử nhóm (2) pư với BaCl2.
+ Xuất hiện kết tủa trắng: K2CO3.
PT: \(K_2CO_3+BaCl_2\rightarrow2KCl+BaCO_{3\downarrow}\)
+ Không hiện tượng: KHCO3.
- Dán nhãn.
2. - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào dd BaCl2.
+ Xuất hiện kết tủa trắng: Na2CO3.
PT: \(Na_2CO_3+BaCl_2\rightarrow2NaCl+BaCO_{3\downarrow}\)
+ Không hiện tượng: NaOH, Ca(OH)2 và HCl. (1)
- Cho mẫu thử nhóm (1) pư với Na2CO3 vừa nhận biết được.
+ Có khí thoát ra: HCl.
PT: \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
+ Không hiện tượng: NaOH, Ca(OH)2. (2)
- Sục CO2 vào mẫu thử nhóm (2).
+ Xuất hiện kết tủa trắng: Ca(OH)2.
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
+ Không hiện tượng: NaOH.
PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
- Dán nhãn.
Đúng 3
Bình luận (2)
dùng phương pháp hoá học phân biệt các muối bị mất nhãn ở dạng rắn sau: CACO3 , Na2SO4 ,KCL
Đúng 0
Bình luận (0)
Chỉ dùng một thuốc thử, trình bày cách nhận biết các dung dịch không màu đựng riêng biệt bị mất nhãn: HCl, NaCl, MgCl2, Na2SO4.
- Dùng quỳ tím
+) Hóa đỏ: HCl
+) Không đổi màu: NaCl, MgCl2 và Na2SO4
- Đổ dd BaCl2 vào từng dd còn lại
+) Xuất hiện kết tủa trắng: Na2SO4
PTHH: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\downarrow\)
+) Không hiện tượng: NaCl và MgCl2
- Đổ dd KOH vào 2 dd còn lại
+) Xuất hiện kết tủa: MgCl2
PTHH: \(MgCl_2+2KOH\rightarrow2KCl+Mg\left(OH\right)_2\downarrow\)
+) Không hiện tượng: NaCl
Đúng 2
Bình luận (0)























