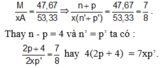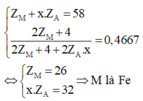Mấy bạn giúp mk với
câu1.Một hợp chất có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim ở chu kì 3. Trong hạt nhân của M có n - p = 4, trong hạt nhân của A có n’ = p’. Tổng số proton trong MAx là 58.
1. Xác định tên nguyên tố, số khối của M, số thứ tự A trong bảng tuần hoàn. 2. Hoàn thành các phương trình hóa học: a. MXx + O2 M2O3 + XO2 b. MXx + HNO3 M(NO3)3 + H2XO4 + NO2 + H2O câu 2 :A, B là 2 kim loại nằm ở 2 chu kỳ liên tiếp thuộc nhóm IIA. Cho 4,4 gam một hỗn hợp gồm A và B tác dụng với dung dịch HCl 1M (dư) thu được 3,36 lit khí (đktc). 1. Viết các phương trình phản ứng và xác định tên 2 kim loại. 2. Tính thể tích dung dịch HCl đã dùng, biết rằng HCl dùng dư 25% so với lượng cần thiết.