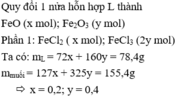Chia 156,8 g hh L gồm FeO, Fe3o4, Fe2O3 thành 2 phần thật đều nhau. Cho phần 1 tác dụng vs HCL dư thu 155,4 g muối khan. p2 tác dụng vừa đủ vs 500ml dd M là hh HCL và H2SO4 loãng thu đc 167,9 muối khan. Viết các phương trình phản ứng xảy ra, xác định phần trăm khối lượng của Fe trong L và CM của dung dịch M

Những câu hỏi liên quan
Chia 156,8 gam hỗn hợp L gồm
F
e
O
,
F
e
3
O
4
,
F
e
2
O
3
thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch M chứa
H
C
l
,
...
Đọc tiếp
Chia 156,8 gam hỗn hợp L gồm F e O , F e 3 O 4 , F e 2 O 3 thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch M chứa H C l , H 2 S O 4 loãng thu được 167,9 gam muối khan. Số mol của HCl trong dung dịch M là
A. 1,75 mol
B. 1,5 mol
C. 1,8 mol
D. 1,0 mol
Chia 156,8 gam hỗn hợp A gồm FeO, Fe3O4, Fe2O3 thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch hỗn hợp HCl, H2SO4 loãng thu được 167,9 gam muối khan. Số mol của HCl trong dung dịch là A. 1,75 mol B. 1,50 mol C. 1,80 mol D. 1,00 mol
Đọc tiếp
Chia 156,8 gam hỗn hợp A gồm FeO, Fe3O4, Fe2O3 thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch hỗn hợp HCl, H2SO4 loãng thu được 167,9 gam muối khan. Số mol của HCl trong dung dịch là
A. 1,75 mol
B. 1,50 mol
C. 1,80 mol
D. 1,00 mol
Đáp án : C
Coi mỗi phần hỗn hợp oxit gồm FeO và Fe2O3 với số mol là a và b
=> Muối P1 có a mol FeCl2 và 2b mol FeCl3
=> 72a + 160b = 156,8.0,5 = 78,4 và 127a + 325b = 155,4
=> a = 0,2 ; b = 0,4 mol => nCl- (muối 1) = 2,8 mol
Xét cả quá trình thì : muối phần 2 chính là muối phần 1 có 1 lượng SO42- thay thế cho Cl-
Cứ x mol SO42- thay thế cho 2x mol Cl-
=> mmuối 2 - mmuối 1 = 96x – 35,3.2x = 167,9 – 155,4 => x = 0,5 mol
=> Số mol Cl bị thay thế là 1,0 mol => số mol Cl trong muối 2 = 2,8 – 1,0 = 1,8 mol
Đúng 0
Bình luận (0)
Chia 156,8 gam hỗn hợp A gồm FeO, Fe3O4, Fe2O3 thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch B là hỗn họp HCl, H2SO4 loãng thu được 167,9 gam muối khan. Số mol của HCl trong dung dịch B là A. 1,75 mol B. 1,50 mol C. 1,80 mol D. 1,00 mol
Đọc tiếp
Chia 156,8 gam hỗn hợp A gồm FeO, Fe3O4, Fe2O3 thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch B là hỗn họp HCl, H2SO4 loãng thu được 167,9 gam muối khan. Số mol của HCl trong dung dịch B là
A. 1,75 mol
B. 1,50 mol
C. 1,80 mol
D. 1,00 mol
Đáp án B

Do số mol cation của 2 phần là như nhau nên tổng điện tích anion của 2 phần là như nhau Suy ra số mol Cl- trong phần 2 bằng 2,8 - 2.0,5 = 1,8 (mol)
Đúng 0
Bình luận (0)
Chia 156,8 gam hh A (FeO, Fe2O3, Fe3O4) thành hai phần bằng nhau.- Phần 1: Cho tác dụng với HCl thu được 155,4 gam muối khan.- Phân 2: Cho tác dụng hết với 500 ml dung dịch M (HCl, H2SO4) thu được 167,9 gam muối khan.a) Tính %mFe trong hỗn hợp A.b) Tính CM các chất trong dd M.Có cách nào không sử dụng bảo toàn điện tích không vậy ạ?
Đọc tiếp
Chia 156,8 gam hh A (FeO, Fe2O3, Fe3O4) thành hai phần bằng nhau.
- Phần 1: Cho tác dụng với HCl thu được 155,4 gam muối khan.
- Phân 2: Cho tác dụng hết với 500 ml dung dịch M (HCl, H2SO4) thu được 167,9 gam muối khan.
a) Tính %mFe trong hỗn hợp A.
b) Tính CM các chất trong dd M.
Có cách nào không sử dụng bảo toàn điện tích không vậy ạ?
Chia 156,8 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3 thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với V ml dung dịch Y là hỗn hợp HCl, H2SO4 loãng thu được 167,9 gam muối khan. Tính số mol của HCl trong dung dịch Y.
Hướng dẫn em theo cách lớp 9 với ạ!
chia 78.4(g) hỗn hợp X gồm FeO và Fe2O3 thành 2 phần đều nhau:
phần 1: cho phần 1 tác dụng hết với DD axit HCL dư thu được 77.7(g) hỗn hợp muối khan
phần 2: phần 2 tác dụng vừa hết với 500ml dd Y gồm HCL và H2SO4(loãng) thu được 83.95(g) hỗn hợp muối khan
xác định khối lượng của mỗi chất trong X và tính nồng độ mol của dd Y
ai giải hộ vs
Gọi x,y tương ứng là số mol của FeO và Fe2O3
Ta có: 72x + 160y = 78,4 và 127.x/2 + 325.y/2 = 77,7. Giải hệ thu được: x = 0,2;y = 0,4 mol.
mFeO = 72.0,2 = 14,4 gam; mFe2O3 = 78,4 - 14,4 = 64 gam.
Phần 2:
Gọi a, b tương ứng là số mol của HCl và H2SO4. Hỗn hợp muối khan gồm FeCl2, FeCl3, FeSO4 và Fe2(SO4)3.
Ta có: 83,95 = mFe + mCl + mSO4 = 56(0,1 + 0,4) + 35,5a + 96b = 28 + 35,5a + 96b
Mặt khác: nCl + 2nSO4 = a + 2b = 2nFeO + 6nFe2O3 = 2.0,1 + 6.0,2 = 1,4
Giải hệ thu được: a = 0,9 và b = 0,25 mol.
Vậy: [HCl] = 0,9/0,5 = 1,8M và [H2SO4] = 0,25/0,5 = 0,5M.
Đúng 0
Bình luận (1)
Chia 156.8g hh L gồm FeO Fe2O3 Fe3O4 thành 2 phần thật đều nhau . Cho phần thứ nhất tác dụng hết với dd HCl dư được 155.4g muối khan. Phần thứ hai tác dụng vừa hết với 500ml dd M là hh HCl H2SO4 loãng thu đc 167.9g muối khan
Viết PTHH phản ứng xảy ra, xác định % m của Fe trong L và Cm của dd M
Chia 156.8g hh L gồm FeO Fe2O3 Fe3O4 thành 2 phần thật đều nhau . Cho phần thứ nhất tác dụng hết với dd HCl dư được 155.4g muối khan. Phần thứ hai tác dụng vừa hết với 500ml dd M là hh HCl H2SO4 loãng thu đc 167.9g muối khan
Viết PTHH phản ứng xảy ra, xác định % m của Fe trong L và Cm của dd M
Hỗn hợp Z gồm FeO, Fe3O4 , Fe2O3 . Lấy 100 g Z chia làm 2 phần bằng nhau.Cho phần thứ nhất tác dụng với dd H2SO4 loãng dư thu được 118 g muối khan. Phần 2 tác dụng vừa đủ 400ml dd Q chứa 2 chất tan là HCl, H2SO4 loãng thu được 111,75 g muối khan.a. Viết các PTHH xảy ra.b. Tính % khối lượng nguyên tố Fe trong hỗn hợp Z.c. Tính CM dd Q.
Đọc tiếp
Hỗn hợp Z gồm FeO, Fe3O4 , Fe2O3 . Lấy 100 g Z chia làm 2 phần bằng nhau.
Cho phần thứ nhất tác dụng với dd H2SO4 loãng dư thu được 118 g muối khan.
Phần 2 tác dụng vừa đủ 400ml dd Q chứa 2 chất tan là HCl, H2SO4 loãng thu được 111,75 g muối khan.
a. Viết các PTHH xảy ra.
b. Tính % khối lượng nguyên tố Fe trong hỗn hợp Z.
c. Tính CM dd Q.