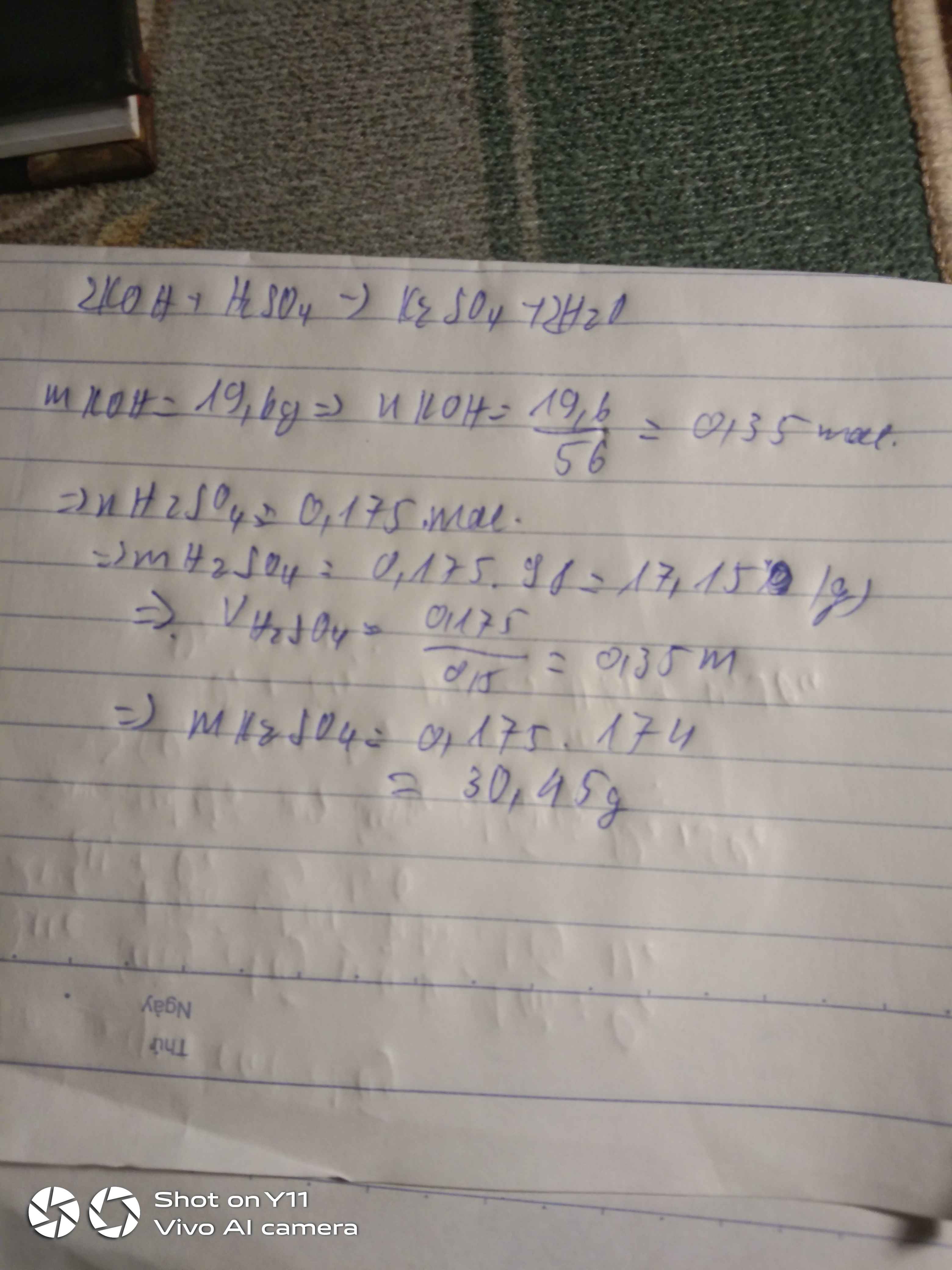ĐỂ TRUNG HÒA 11.2G DUNG DỊCH KOH 25% THÌ CẦN DÙNG BAO NHIÊU GAM DUNG DỊCH H2SO4 4.9%

Những câu hỏi liên quan
Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%:
A. 400 g
B. 500 g
C. 420 g
D. 570 g
Câu 6: Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%:
Câu 1: Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%?giải chi tiết
Đọc tiếp
Câu 1: Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%?
giải chi tiết
Câu 1 :
\(n_{KOH}=\dfrac{25\%.112}{100\%.56}=0,5\left(mol\right)\)
Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
\(n_{H2SO4}=\dfrac{1}{2}n_{KOH}=0,25\left(mol\right)\Rightarrow m_{ddH2SO4}=\dfrac{0,25.98}{4,9\%}.100\%=500\left(g\right)\)
Đúng 3
Bình luận (0)
Để trung hòa 11,2gam KOH 20%, thì cần lấy bao nhiêu gam dung dịch acid H2SO4 35%
Ta có: \(C_{\%_{KOH}}=\dfrac{m_{KOH}}{11,2}.100\%=20\%\)
=> mKOH = 2,24(g)
=> \(n_{KOH}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
PTHH: 2KOH + H2SO4 ---> K2SO4 + 2H2O
Theo PT: \(n_{H_2SO_4}=\dfrac{1}{2}.n_{KOH}=\dfrac{1}{2}.0,04=0,02\left(mol\right)\)
=> \(m_{H_2SO_4}=0,02.98=1,96\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{1,96}{m_{dd_{H_2SO_4}}}.100\%=35\%\)
=> \(m_{dd_{H_2SO_4}}=5,6\left(g\right)\)
Đúng 1
Bình luận (0)
Để trung hòa 11,2gam KOH 20%, thì cần lấy bao nhiêu gam dung dịch axit H2SO4 35%
\(n_{KOH}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2\)(mol)
PTHH : 2KOH + H2SO4 ---> K2SO4 + 2H2O
2 : 1 : 1 : 2
0.2mol 0.1mol
\(m_{H_2SO_4}=n.M=0,1.98=9,8\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{m_{H_2SO_4}.100\%}{C\%}=\dfrac{9,8.100\%}{35\%}=28\left(g\right)\)
Đúng 0
Bình luận (0)
\(n_{KOH}=\dfrac{11,2.20}{100.56}=0,04\left(mol\right)\)
PTHH: 2KOH + H2SO4 --> K2SO4 + 2H2O
_____0,04---->0,02
=> mH2SO4 = 0,02.98 = 1,96 (g)
=> \(m_{ddH_2SO_4}=\dfrac{1,96.100}{35}=5,6\left(g\right)\)
Đúng 0
Bình luận (0)
Để trung hòa 56 gam dung dịch KOH 35% thì cần bao nhiêu ml dung dịch H2SO4 0,5M? Tính khối lượng muối thu được sau phản ứng?
| Trung hòa 20 ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. |
| a- Tính khối lượng dung dịch NaOH cần dùng ? |
| b- Nếu trung hòa dung dịch H2SO4 trên bằng dung dịch KOH 5,6%, có D = |
| 1,045 g/ml thì cần bao nhiêu ml dung dịch KOH ? |
| Cho : H = 1 S = 32 O = 16 Na = 23 K = 39 |
nH2SO4=0,02.1=0,02(ol)
a) PTHH: 2 NaOH + H2SO4 -> Na2SO4 + 2 H2O
0,04____________0,02____0,02(mol)
mNaOH=0,04.40= 1,6(g)
=>mddNaOH= (1,6.100)/20= 8(g)
b) PTHH: H2SO4 + 2 KOH -> K2SO4 + 2 H2O
0,2____________0,04(mol)
=>mKOH=0,04.56=2,24(g)
=>mddKOH= (2,24.100)/5,6=40(g)
=>VddKOH= mddKOH/DddKOH= 40/1,045=38,278(ml)
Đúng 1
Bình luận (0)
Để trung hòa 1,12gam KOH thì cần lấy bao nhiêu gam dung dịch axit H2SO4 35%
A/ 0,98 gam B/ 1,98 gam C/ 2,8 gam D/ 5,6 gam
\(n_{OH^-}=n_{KOH}=\dfrac{1,12}{56}=0,02mol\)
Để trung hòa\(\Rightarrow n_{H^+}=n_{OH^-}=0,02mol\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{H^+}=0,01mol\Rightarrow m=0,98g\)
\(m_{dd}=\dfrac{0,98}{35}\cdot100=2,8\left(g\right)\)
Chọn C.
Đúng 1
Bình luận (1)
Bài 3. Trung hòa 100 ml dung dịch KOH 0,5M bằng dung dich H2SO4 1M
a) Viết PTHH
b) Tính thể tích dung dịch H2SO4 cần dùng.
c) Nếu trung hòa lượng KOH trên bằng dd HCl 20% thì cần bao nhiêu gam dd?
(Cho K=39, H=1, O=16, S=32, Cl=35,5)
Đổi 100ml = 0,1 lít
Ta có: \(C_{M_{KOH}}=\dfrac{n_{KOH}}{0,1}=0,5M\)
=> \(n_{KOH}=0,05\left(mol\right)\)
a. PTHH: 2KOH + H2SO4 ---> K2SO4 + 2H2O
b. Theo PT: \(n_{H_2SO_4}=\dfrac{1}{2}.n_{KOH}=\dfrac{1}{2}.0,05=0,025\left(mol\right)\)
Vì H2SO4 là chất lỏng nên thể tích bằng số mol của chính nó.
c. PTHH: KOH + HCl ---> KCl + H2O
Theo PT: \(n_{HCl}=n_{KOH}=0,05\left(mol\right)\)
=> \(m_{HCl}=0,05.36,5=1,825\left(g\right)\)
Ta có; \(C_{\%_{HCl}}=\dfrac{1,825}{m_{dd_{HCl}}}.100\%=20\%\)
=> \(m_{dd_{HCl}}=9,125\left(g\right)\)
Đúng 3
Bình luận (1)