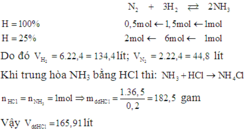điều chế 3.36 1 lít khí hidro cần bao nhiêu gam nhôm và bao nhiêu ml dung dịch HCl 1,5 m

Những câu hỏi liên quan
cần bao nhiêu gam kmno4 và bao nhiêu ml dung dịch axit HCL 1M để điều chế được 11,2 lít khí Clo ở(đktc)?
\(n_{Cl_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(2KMnO_4+16HCl_{\left(đ\right)}\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.2...................1.6...........................................0.5\)
\(m_{KMnO_4}=0.2\cdot158=31.6\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{1.6}{1}=1.6\left(l\right)=1600\left(ml\right)\)
Đúng 0
Bình luận (0)
\(n_{Cl_2}=\dfrac{11,2}{22,4}=0,5(mol)\\ PTHH:2KMnO_4+16HCl\to 2KCl+2MnCl_2+5Cl_2+8H_2O\\ \Rightarrow n_{KMnO_4}=\dfrac{2}{5}n_{Cl_2}=0,2(mol);n_{HCl}=\dfrac{16}{5}n_{Cl_2}=1,6(mol)\\ \Rightarrow m_{KMnO_4}=0,2.158=31,6(g);V_{dd_{HCl}}=\dfrac{1,6}{1}=1,6(l)=1600(ml)\)
Đúng 0
Bình luận (0)
Một quả bóng bay nhỏ, bơm căng chứa 1,68 lít khí hiđro H2 (ở đktc). Vậy nếu dùng nhôm Al và dung dịch axit clo hiđric HCl 7,3% điều chế khí H2 để bơm vào 10 quả bóng bay như trên thì cần tối thiểu: a. bao nhiêu gam nhôm Al? b. bao nhiêu gam dung dịch axit clo hiđric HCl 7,3%? Biết phản ứng xảy ra hoàn toàn. ( H = 1; Al = 27, Cl = 35,5)
2Al+6HCl->2AlCl3+3H2
0,5----1,5-------------------------0,75
n H2=0,075 mol
cần 10 quả bóng =>0,075.10=0,75 mol
=>mAl=0,5.27=13,5g
m HCl=1,5.36,5=54,75g
=>m dd=75g
Đúng 1
Bình luận (1)
\(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\
pthh:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1125 0,15 0,075
\(m_{Al}=0,1125.27=3,0375\left(g\right)\\
m_{HCl}=\dfrac{\left(0,15.36,5\right).100}{7,3}=75\left(g\right)\)
. Cần bao nhiêu gam KMnO4 và bao nhiêu lít dung dịch axit HCl 1M để điều chế được 11,2 lít khí clo (ở đktc)?
Cần bao nhiêu gam KMnO4 và bao nhiêu ml dung dịch HCl 1M để điều chế đủ khí Clo tác dụng với Fe tạo nên 16,25 gam FeCl3 ?
Xem chi tiết
\(n_{FeCl_3}=\dfrac{16.25}{162.5}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{t^0}FeCl_3\)
\(......0.15......0.1\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.06...............0.48........................................0.15\)
\(m_{KMnO_4}=0.06\cdot158=9.48\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{0.48}{1}=0.48\left(l\right)=480\left(ml\right)\)
Đúng 3
Bình luận (2)
\(2Fe+ 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = \dfrac{3}{2}n_{FeCl_3} = \dfrac{3}{2}.\dfrac{16,25}{162,5} = 0,15(mol)\\ 2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O\\ n_{KMnO_4} = \dfrac{2}{5}n_{Cl_2} = 0,06(mol)\\ \Rightarrow m_{KMnO_4} = 0,06.158 = 9,48(gam)\\ n_{HCl} = \dfrac{16}{4}n_{Cl_2} = 0,48(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,48}{1} = 0,48(lít) = 480(ml)\)
Đúng 1
Bình luận (0)
Phải dùng bao nhiêu lít N2 và H2 (đktc) để điều chế 17 gam NH3. Biết hiệu suất chuyển hoán thành NH3 là 25%. Nếu dùng dung dịch HCl 20% (d 1,1g/ml) để trung hòa lượng NH3 trên thì cần bao nhiêu ml? A. 165,91 lít B. 163 lít C. 175,91 lít D. 153 lít
Đọc tiếp
Phải dùng bao nhiêu lít N2 và H2 (đktc) để điều chế 17 gam NH3. Biết hiệu suất chuyển hoán thành NH3 là 25%. Nếu dùng dung dịch HCl 20% (d = 1,1g/ml) để trung hòa lượng NH3 trên thì cần bao nhiêu ml?
A. 165,91 lít
B. 163 lít
C. 175,91 lít
D. 153 lít
Câu 2: Trộn 200 ml dung dịch HCl 1M với 300 ml dung dịch HCl 1,5 M thu được dung dịch HCl có nồng độ mol/lit là bao nhiêu?
Câu 3: Cần thêm bao nhiêu ml H2O (D = 1 g/ml) vào 100 gam dung dịch NaOH 35% để thu được dung dịch NaOH 20%.
Câu 4: Cần pha bao nhiêu lít dung dịch HCl 2M với bao nhiêu lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M.
Câu 2 :
$n_{HCl} = 0,2.1 + 0,3.1,5 = 0,65(mol)$
$V_{dd} = 0,2 + 0,3 = 0,5(mol)$
$C_{M_{HCl}} = \dfrac{0,65}{0,5} =1,3M$
Câu 3 :
Gọi $m_{H_2O\ cần\ thêm} =a (gam)$
Sau khi thêm :
$m_{NaOH} = 100.35\% = 35(gam)$
$m_{dd} = 100 + a(gam)$
Suy ra: $\dfrac{35}{100 + a}.100\% = 20\%$
Suy ra: a = 75(gam)
Câu 4 :
Gọi $V_{dd\ HCl\ 2M} =a (lít) ; V_{dd\ HCl\ 3M} = b(lít)$
Ta có :
$a + b = 4$
$2a + 3b = 4.2,75$
Suy ra a = 1(lít) ; b = 3(lít)
Đúng 2
Bình luận (0)
a. Phải dùng hết bao nhiêu lít H2 để điều chế hết 32g Sắt (III) oxit
b. Nếu dùng Al và dung dịch 20% để điều chế H2 đủ dùng cho phản ứng trên thì cần dùng bao nhiêu gam dung dịch HCl 20% nói trên
c. Nếu dùng không khí có 20% thể tích O2 để đốt cháy hết lượng gam Nhôm ở câu b thì dùng bao nhiêu lít không khí ( đktc )
a) \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,2----->0,6
=> VH2 = 0,6.22,4 = 13,44 (l)
b) PTHH: 2Al + 6HCl ---> 2AlCl3 + 3H2
0,4<-1,2<------------------0,6
=> \(m_{ddHCl}=\dfrac{1,2.36,5}{20\%}=219\left(g\right)\)
c) PTHH: 4Al + 3O2 --to--> 2Al2O3
0,4<---0,3
=> Vkk = 0,3.22,4.5 = 33,6 (l)
Đúng 1
Bình luận (0)
Câu 3: Cần thêm bao nhiêu ml H2O (D = 1 g/ml) vào 100 gam dung dịch NaOH 35% để thu được dung dịch NaOH 20%. Câu 4: Cần pha bao nhiêu lít dung dịch HCl 2M với bao nhiêu lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M.
\(m_{NaOH\left(35\%\right)}=100.35\%=35\left(g\right)\)
\(m_{ddNaOH\left(20\%\right)}=\dfrac{35}{20}.100=175\left(g\right)\)
⇒ mnước thêm vào = 175-100 = 75(g)
Vnước thêm vào = 75.1 = 75 (ml)
Đúng 1
Bình luận (1)
Câu 4:
\(n_{HCl}=4.2,75=11\left(mol\right)\)
Ta có: \(V_{ddHCl\left(2M\right)}=\dfrac{n_{HCl\left(1\right)}}{2}\left(l\right);V_{ddHCl\left(3M\right)}=\dfrac{n_{HCl\left(2\right)}}{3}\left(l\right)\)
\(\Rightarrow V_{ddHCl\left(2M\right)}+V_{ddHCl\left(3M\right)}=\dfrac{n_{HCl\left(1\right)}}{2}+\dfrac{n_{HCl\left(2\right)}}{3}\)
\(\Leftrightarrow4=\dfrac{3n_{HCl\left(1\right)}+2n_{HCl\left(2\right)}}{6}\Leftrightarrow3n_{HCl\left(1\right)}+2n_{HCl\left(2\right)}=24\)
Ta có: \(\left\{{}\begin{matrix}n_{HCl\left(1\right)}+n_{HCl\left(2\right)}=11\\3n_{HCl\left(1\right)}+2n_{HCl\left(2\right)}=24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}n_{HCl\left(1\right)}=2\\n_{HCl\left(2\right)}=9\end{matrix}\right.\)
\(\Rightarrow V_{ddHCl\left(2M\right)}=\dfrac{2}{2}=1\left(l\right);V_{ddHCl\left(3M\right)}=\dfrac{9}{3}=3\left(l\right)\)
Đúng 1
Bình luận (0)
Câu 3:
\(m_{NaOH}=35.100\%=35\left(g\right)\\ m_{H_2O\left(thêm\right)}=a\left(g\right)\\ \Rightarrow\dfrac{35}{100+a}.100\%=20\%\\ \Leftrightarrow a=75\left(g\right)\\ \Rightarrow V_{H_2O\left(thêm\right)}=\dfrac{75}{1}=75\left(ml\right)\)
Câu 4:
\(Đặt:V_{ddHCl\left(pha.thêm2M\right)}=a\left(l\right)\\ V_{ddHCl\left(pha.thêm3M\right)}=b\left(l\right)\\ \Rightarrow\dfrac{2a+3b}{a+b}=2,75\left(1\right)\\ Mà:a+b=4\left(2\right)\\ Từ\left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=1\left(l\right)\\b=3\left(l\right)\end{matrix}\right.\)
Vậy cần pha 1 lít dung dịch HCl 2M vào 3 lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M
Chúc em học tốt!
Đúng 1
Bình luận (0)