48 g Fe2O3 tác dụng vừa đủ m g H2SO4 10%
Tìm m
TÌm kl dd sau PƯ
Tìm C% muối thu đc

Những câu hỏi liên quan
Bài 10: Đốt cháy 16,8 g Fe trong khí Oxi vừa đủ thì thu được Fe2O3. Cho toàn bộ lượng Fe2O3 tạo thành sau phản ứng này tác dụng với m (g) H2SO4.a) Tìm thể tích khí Oxi để đốt cháy lượng sắt trênb) Tìm mBài 11: Cho 48 g Fe2O3 tác dụng vừa đủ với HCl.a) Tìm khối lượng của FeCl3 tạo thànhb) Tìm khối lượng của HCl
Đọc tiếp
Bài 10: Đốt cháy 16,8 g Fe trong khí Oxi vừa đủ thì thu được Fe2O3. Cho toàn bộ lượng Fe2O3 tạo thành sau phản ứng này tác dụng với m (g) H2SO4.
a) Tìm thể tích khí Oxi để đốt cháy lượng sắt trên
b) Tìm m
Bài 11: Cho 48 g Fe2O3 tác dụng vừa đủ với HCl.
a) Tìm khối lượng của FeCl3 tạo thành
b) Tìm khối lượng của HCl
10.
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(4Fe+3O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3\)
\(0.3.....0.225....0.15\)
\(V_{O_2}=0.225\cdot22.4=5.04\left(l\right)\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(0.15...........0.45\)
\(m_{H_2SO_4}=0.45\cdot98=44.1\left(g\right)\)
11.
\(n_{Fe_2O_3}=\dfrac{48}{160}=0.3\left(mol\right)\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(0.3...........1.8...........0.6\)
\(m_{FeCl_3}=0.6\cdot162.5=97.5\left(g\right)\)
\(m_{HCl}=1.8\cdot36.5=65.7\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 10:
\(a,n_{Fe}=\dfrac{16,8}{56}=0,3(mol)\\ PTHH:4Fe+3O_2\xrightarrow{t^o}2Fe_2O_3\\ Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2O\\ \Rightarrow n_{O_2}=\dfrac{3}{4}n_{Fe}=0,225(mol)\\ \Rightarrow V_{O_2}=0,225.22,4=5,04(l)\\ b,n_{H_2SO_4}=3n_{Fe_2O_3}=3.\dfrac{1}{2}n_{Fe}=0,45(mol)\\ \Rightarrow m_{H_2SO_4}=0,45.98=44,1(g)\)
Bài 11:
\(a,n_{Fe_2O_3}=\dfrac{48}{160}=0,3(mol)\\ PTHH:Fe_2O_3+6HCl\to 2FeCl_3+3H_2O\\ \Rightarrow n_{FeCl_3}=2n_{Fe_2O_3}=0,6(mol)\\ \Rightarrow m_{FeCl_3}=0,6.162,5=97,5(g)\\ b,n_{HCl}=6n_{Fe_2O_3}=1,8(mol)\\ \Rightarrow m_{HCl}=1,8.36,5=65,7(g)\)
Đúng 0
Bình luận (0)
1. Hòa tan hoàn toàn 2,81 g hh Fe2o3, mgo, zno trong 500 ml dd h2so4 0,1M vừa đủ khô cạn dd thu đc bao nhiêu gam muối khan.
2. Cho 24,4 g hh Na2co3, k2co3 tác dụng vừa đủ dd BaCl2 pư xong thu được 39,4 gam kết tủa. Lọc kết tủa khô cạn dd m gam muối clorua. Tìm gt m?
Giúp minh với nhé!
1. áp dụng bảo toàn khối lượng:
nH2O = nH2SO4 = 0.5*0.1 = 0.05mol
--> mmuoi = 2.81 + 0.05*98 - 0.05*18 = 6.81g
2 . Sửa đề lại là 39,4g kết tủa mới chính xác.Số như vậy tính ra thì lẻ,ít đẹp
nBaCO3 = 39,4/197 = 0,2
=> nBaCl2 = 0,2 => mBaCl2 = 0,2*208 = 41,6g
=> m muối clorua = mhh + mBaCl2 - mBaCO3 = 24,4 + 41,6 - 39,4 = 26,6g
Đúng 0
Bình luận (0)
Giúp em với ạBài 10: Đốt cháy 16,8 g Fe trong khí Oxi vừa đủ thì thu được Fe2O3. Cho toàn bộ lượng Fe2O3 tạo thành sau phản ứng này tác dụng với m (g) H2SO4.a) Tìm thể tích khí Oxi để đốt cháy lượng sắt trênb) Tìm mBài 11: Cho 48 g Fe2O3 tác dụng vừa đủ với HCl.a) Tìm khối lượng của FeCl3 tạo thànhb) Tìm khối lượng của HClBài 12: Cho 24 g Ca tác dụng với H2SO4 có trong dung dịch loãng.a) Tìm thể tích khí Hiđro sinh ra (ở đktc)b) Tìm khối lượng của H2SO4c) Tìm khối lượng...
Đọc tiếp
Giúp em với ạ
Bài 10: Đốt cháy 16,8 g Fe trong khí Oxi vừa đủ thì thu được Fe2O3. Cho toàn bộ lượng Fe2O3 tạo thành sau phản ứng này tác dụng với m (g) H2SO4.
a) Tìm thể tích khí Oxi để đốt cháy lượng sắt trên
b) Tìm m
Bài 11: Cho 48 g Fe2O3 tác dụng vừa đủ với HCl.
a) Tìm khối lượng của FeCl3 tạo thành
b) Tìm khối lượng của HCl
Bài 12: Cho 24 g Ca tác dụng với H2SO4 có trong dung dịch loãng.
a) Tìm thể tích khí Hiđro sinh ra (ở đktc)
b) Tìm khối lượng của H2SO4
c) Tìm khối lượng của CaSO4 tạo thành sau phản ứng
Bài 13: Cho 32 g Oxi tác dụng vừa đủ với Magie.
a) Tìm khối lượng của Mg trong phản ứng.
b) Tìm khối lượng của Magie oxit tạo thành
Bài 14: Để điều chế 55,5 g CaCl2 người ta cho Ca tác dụng với HCl
a) Tìm khối lượng của Ca và HCl trong phản ứng
b) Tìm thể tích khí Hiđro sinh ra (ở đktc)
Em tách từng câu hỏi gồm 1 hoặc 2 bài nhé ! Đăng nhiều như thế này rối lắm.
Đúng 0
Bình luận (0)
Cho x gam hỗn hợp gồm MgO,
F
e
2
O
3
, ZnO, CuO tác dụng vừa đủ với 50g dd
H
2
S
O
4
11,76%. Cô cạn dd sau phản ứng thu được 8,41 g muối khan. Giá trị của m là: A. 3,2g B. 3,5g C. 3,61g D. 4,2g
Đọc tiếp
Cho x gam hỗn hợp gồm MgO, F e 2 O 3 , ZnO, CuO tác dụng vừa đủ với 50g dd H 2 S O 4 11,76%. Cô cạn dd sau phản ứng thu được 8,41 g muối khan. Giá trị của m là:
A. 3,2g
B. 3,5g
C. 3,61g
D. 4,2g
Tương tự bài 1, ta có:
m 4 o x i t = m m u o i - m H 2 S O 4 + m H 2 O s a n p h a m
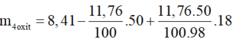
m 4 o x i t = 3,61g
⇒ Chọn C.
Đúng 0
Bình luận (0)
hòa tan hết 41,76 g một oxit kl M trong 126g dd H2SO4 70% (đn ,vừa đủ) thu đc dd và 2,016 l SO2(dktc) xử lí dd sau pứ thì thu đc 151,74 g Muối X .xd ng tố M
Hỗn hợp Z gồm FeO, Fe3O4 , Fe2O3 . Lấy 100 g Z chia làm 2 phần bằng nhau.Cho phần thứ nhất tác dụng với dd H2SO4 loãng dư thu được 118 g muối khan. Phần 2 tác dụng vừa đủ 400ml dd Q chứa 2 chất tan là HCl, H2SO4 loãng thu được 111,75 g muối khan.a. Viết các PTHH xảy ra.b. Tính % khối lượng nguyên tố Fe trong hỗn hợp Z.c. Tính CM dd Q.
Đọc tiếp
Hỗn hợp Z gồm FeO, Fe3O4 , Fe2O3 . Lấy 100 g Z chia làm 2 phần bằng nhau.
Cho phần thứ nhất tác dụng với dd H2SO4 loãng dư thu được 118 g muối khan.
Phần 2 tác dụng vừa đủ 400ml dd Q chứa 2 chất tan là HCl, H2SO4 loãng thu được 111,75 g muối khan.
a. Viết các PTHH xảy ra.
b. Tính % khối lượng nguyên tố Fe trong hỗn hợp Z.
c. Tính CM dd Q.
Cho 13,6 gam hỗn hợp gồm Fe và Fe2o3 tác dụng vừa đủ với dd H2SO4 sau phản ứng thấy thoát ra 2,24 lít khí
a) Tính KL mỗi chất trong hỗn hợp ban đầu
b) Tính nồng độ % môi muối trong hỗn hợp muối thu dcd sau phản ứng
c) Cho lượng hỗn hợp trên tác dụng vừa đủ 150g dd HCL, sau phản ứng thu đc thể tích dd H2SO4 đã dùng
GIÚP MÌNH VỚI
a) \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1
PTHH: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Mol: 0,05 0,05
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=13,6-5,6=8\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
b và c ko hiểu đề
Đúng 0
Bình luận (0)
Bài 3: Cho 4,8 gam Fe2O3 tác dụng với 1 lượng vừa đủ dd axit H2SO4 9,8% vừa đủ. Sau phản ứng thu được muối Fe2(SO4)3 và nước. Hãy tính khối lượng của dd axit đã phản ứng và khối muối thu được
PTHH: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{4,8}{160}=0,03\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=0,09\left(mol\right)\\n_{Fe_2\left(SO_4\right)_3}=0,03\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{ddH_2SO_4}=\dfrac{0,09\cdot98}{9,8\%}=90\left(g\right)\\m_{Fe_2\left(SO_4\right)_3}=0,03\cdot400=12\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hòa tan 1 viên zn vào 200 ml dd H2SO4 thu đc 1,12 l khí H2 ở đktc.Hãy tìm:
a)KL của viên kẽm
b)Nồng độ M của dd H2SO4 ban đầu,giả sử lượng axit vừa đủ cho Pứ
c)Tính KL của muối thu đc sau Pứ
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.05.......0.05......0.05...........0.05\)
\(m_{Zn}=0.05\cdot65=3.25\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(m_{ZnSO_4}=0.05\cdot161=8.05\left(g\right)\)
Đúng 2
Bình luận (0)



















