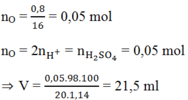cho 10,8 g Al tác dụng với 200g dung dịch H2SO4 X%
1,viết PTHH
2,Cx%
3,Thể tích H2 (đktc)
cho biết Al tác dụng với 58,8g axit sunfuric (H2SO4) thu được nhôm sunfat ( Al2(SO4)3) và khí H2. Viết PTHH và tính khối lượng Al đã phản ứng. Tính khối lượng nhôm sunfat và thể tích khí H2 sinh ra ở điều kiện tiêu chuẩn.
Ta có: \(n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
\(PTHH:2Al+3H_2SO_4--->Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,4 <--- 0,6 -----------> 0,2 --> 0,6
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4.27=10,8\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\\V_{H_2}=0,6.22,4=13,44\left(lít\right)\end{matrix}\right.\)
Cho một lượng bột Al vào dung dịch CuSO4 dư, lấy rắn thu được cho tác dụng dung dịch HNO3 dư thấy sinh ra 2,24 lít NO (đktc). Nếu đem lượng Al trên tác dụng hết với dung dịch HNO3 sẽ thu được thể tích N2 đktc là:
A. 0,896 lít.
B. 0,448 lít.
C. 0,336 lít.
D. 0,672 lít.
Đáp án D
- Khi Al + CuSO4 dư: ne = 3nAl = 2nCu
- Khi Cu + HNO3 dư: ne = 2nCu = 3nNO
=> nAl = nNO = 2,24: 22,4 = 0,1 mol
- Khi Al + HNO3: ne = 3nAl = 10nN2
=> nN2 = 3.0,1: 10 = 0,03 mol
=> VN2 = 0,03.22,4 = 0,672 lít
Tính theo PTHH, lượng dư, Nồng độ dung dịch?
cho 11,2g sắt tác dụng với 400ml dung dịch HCL
a, Tính thể tích H2 sinh ra ở đktc?
b, Tính nồng độ mol của dung dịch HCL đã dùng ?
c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam Fe
Trả Lời
nFe=11.2\56=0.2(o)nFe=11.2\56=0.2(mol)
+
0.2.......0.4...................0.2
VH2=0.2⋅22.4=4.48(l)VH2=0.2⋅22.4=4.48(l)
CMHCl=0.4\0.4=1(M)CMHCl=0.4\0.4=1(M)
nCuO=8\80=0.1(mol)nCuO=8\80=0.1(mol)
CuO+H2t0→Cu+H2OCuO+H2t0→Cu+H2O
1............11............1
0.1.........0.20.1.........0.2
LTL:0.11<0.21⇒H2dưLTL:0.11<0.21⇒H2dư
nCu=nCuO=0.1(mol)nCu=nCuO=0.1(mol)
mCu=0.1⋅64=6.4(g)
CHO HỎi
NFe = 11.2\56 = 0,2 mol thì 56 lấy đâu ra ạ
56 là nguyên tử khối cùa Fe nhé , em có thể xem lại trong bảng.
Tính theo PTHH, lượng dư, Nồng độ dung dịch?
cho 11,2g sắt tác dụng với 400ml dung dịch HCL
a, Tính thể tích H2 sinh ra ở đktc?
b, Tính nồng độ mol của dung dịch HCL đã dùng ?
c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam Fe
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2.......0.4...................0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0.4}{0.4}=1\left(M\right)\)
\(n_{CuO}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(1............1\)
\(0.1.........0.2\)
\(LTL:\dfrac{0.1}{1}< \dfrac{0.2}{1}\Rightarrow H_2dư\)
\(n_{Cu}=n_{CuO}=0.1\left(mol\right)\)
\(m_{Cu}=0.1\cdot64=6.4\left(g\right)\)
Chúc em học tốt và có những trải nghiệm tuyệt vời tại hoc24.vn nhé !
a) nFe=0,2(mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
0,2_________0,4____0,2___0,2(mol)
V(H2,dktc)=0,2.22,4=4,48(l)
b) VddHCl=0,4/0,4=1(l)
c) nCuO=0,1(mol)
PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,2/1 > 0,1/1
=> CuO hết, H2 dư, tính theo nCuO
-> nCu=nCuO=0,1(mol)
=>mCu=0,1.64=6,4(g)
CMHCl=0.40.4=1(M)CMHCl=0.40.4=1(M)
LTL:0.11<0.21⇒H2dưLTL:0.11<0.21⇒H2dư
nCu=nCuO=0.1(mol)nCu=nCuO=0.1(mol)
mCu=0.1⋅64=6.4(g)
Một mẫu K và Ba tác dụng với H2O dư thu được dung dịch X và 3,36 lít H2. Tính thể tích dung dịch H2SO4 2M cần dùng để trung hoà dung dịch X
A. 150 ml
B. 200 ml
C. 300 ml
D. 75 ml
Đáp án D
X + nH2O → X(OH)n + n/2 H2.
Ta có: n H 2 = 0,15 mol → n O H - = 2 n H 2 = 0,3 mol → n H + = 0,3 mol → 2. 2V = 0,3 → V = 0,075 (lít)
Một mẫu K và Ba tác dụng với H2O dư thu được dung dịch X và 3,36 lít H2. Tính thể tích dung dịch H2SO4 2M cần dùng để trung hoà dung dịch X
A. 150 ml
B. 200 ml
C. 300 ml
D. 75 ml
Đáp án D
X + nH2O → X(OH)n + n/2 H2.
Ta có: n(H2) = 0,15 mol → n(OH-) = 2n (H2) = 0,3 mol → n(H+) = 0,3 mol → 2. 2V = 0,3 → V = 0,075 (lít)
cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M
a) viết PTHH
b) tính thể tích dung dịch HCl đã dùng
\(n_{MgCO_3}=\dfrac{21}{84}=0,25\left(mol\right)\\ a.MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ n_{HCl}=0,25.2=0,5\left(mol\right)\\ b.V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
Đốt cháy hoàn toàn 33.4 gam hỗn hợp X gồm Al,Fe,Cu ngoài không khí thu được 41,4 gam hỗn hợp Y gồm 3 oxit . cho Y tác dụng hoàn toàn với dung dịch H2SO4 20% biết D=1,14 g/ml , thể tích tối thiểu của dung dịch H2SO4 20% để hoà tan hết hỗn hợp Y là bao nhiêu?
o mol o2 pu la :(41,4-33,4)/32=0,25 mol
o2 +4e ->2 o2-
2h+ +2e ->h2
=>so mol h+ la 4.0,25=1 mol
so mol h2so4 la 0,5 mol
=>v=(0,5.98.5)/1,14=215 ml
Đốt cháy hoàn toàn 3,86g hỗn hợp gồm Fe, Al, Cu thu được 4,66g oxit. Cho toàn bộ lượng oxit này tác dụng với dung dịch axit H2SO4 20% (d = 1,14 g/ml). Vậy thể tích H2SO4 cần dùng tối thiểu là:
A. 21,1 ml
B.21,5 ml
C. 23,4 ml
D. 19,6 ml
Đáp án B
mO = moxit - mkim loại = 4,66 - 3,86 = 0,8g