Cho m (gam) phenol C6H5OH tác dụng với natri dư thấy thoát ra 0,56 lít khí H2 (đktc) khối lượng m cần dùng là
Giúp mk với
Cho m gam phenol (C6H5OH) tác dụng với natri dư thấy thoát ra 0,56 lít khí H2 (đktc), giá trị m của là
A. 4,7
B. 9,4C. 7,4.
C. 7,4.
D. 4,9.
Cho m gam phenol (C6H5OH) tác dụng với natri dư thấy thoát ra 0,56 lít khí H2 (đktc), giá trị m của là
A. 4,7.
B. 4,9.
C. 9,4.
D. 7,4.
Đáp án A
+ n C 6 H 5 O H = 2 n H 2 = 0 , 05 ⇒ m C 6 H 5 O H = 4 , 7 g a m
Câu 1: Cho m gam phenol tác dụng với natri dư thấy thoát ra 0.56 lít khí H2 (đktc) Tính khối lượng phenol cần dùng. Câu 2: Chi 4,7 gam phenol tác dụng với nước brom dư, thu được m gam kết tủa Tính m
Câu 1:
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
PTHH: \(2C_6H_5OH+2Na\underrightarrow{t^o}2C_6H_5ONa+H_2\)
0,05<--------------------------0,025
=> m = 0,05.94 = 4,7 (g)
Câu 2:
\(n_{C_6H_5OH}=\dfrac{4,7}{94}=0,05\left(mol\right)\)
PTHH: \(C_6H_5OH+3Br_2\rightarrow C_6H_2Br_3OH\downarrow+3HBr\)
0,05--------------->0,05
=> m = 0,05.331 = 16,55 (g)
Cho 14 gam hỗn hợp A gồm phenol và etanol tác dụng với Na dư thấy thoát ra 2,24 lít khí H 2 ở đktc. Thành phần phần trăm khối lượng phenol trong A là:
A. 67,14%.
B. 64,17%.
C. 61,74%.
D. 64,71%.
- Gọi số mol phenol và etanol lần lượt là a và b (mol)
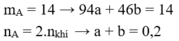
- Giải hệ được a = 0,1và b = 0,1
→ % m phenol = 67,14%.
- Chọn đáp án A.
: Cho 2,06 gam hỗn hợp 2 kim loại Na và Ba tác dụng với một lượng nước dư, thấy thoát ra 0,56 lít khí H2 (đktc).
a) Tính tổng khối lượng bazơ sinh ra.
b) Tính khối lượng từng kim loại trong hỗn hợp.
2Na+2H2O->2NaOH+H2
x-------------------x----------0,5x mol
Ba+2H2O->Ba(OH)2+H2
y---------------------y----------y mol
aTa có :)\(\left\{{}\begin{matrix}23x+137y=2,06\\0,5x+y=0,025\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,03\\y=0,01\end{matrix}\right.\)
=>mbazo=0,03.40+0,01.171=2,91g
=>m Na=0,03.23=0,69g
=>m Ba=0,01.137=1,27g
Dung dịch A chứa a mol HCl và b mol HNO3. Cho A tác dụng với một lượng vừa đủ m gam Al thu được dung dịch B và 7,84 lít hỗn hợp khí C (đktc) gồm NO, N2O và H2 có tỉ khối so với H2 là 8,5. Trộn C với một lượng O2 vừa đủ và đun nóng cho phản ứng hoàn toàn, rồi dẫn khí thu được qua dung dịch NaOH dư thấy còn lại 0,56 lít khí (đktc) thoát rA. Giá trị của a và b tương ứng là:
A. 0,1 và 2.
B. 1 và 0,2.
C. 2 và 0,1.
D. 0,2 và 1.
Dung dịch A chứa a mol HCl và b mol HNO3. Cho A tác dụng với một lượng vừa đủ m gam Al thu được dung dịch B và 7,84 lít hỗn hợp khí C (đktc) gồm NO, N2O và H2 có tỉ khối so với H2 là 8,5. Trộn C với một lượng O2 vừa đủ và đun nóng cho phản ứng hoàn toàn, rồi dẫn khí thu được qua dung dịch NaOH dư thấy còn lại 0,56 lít khí (đktc) thoát rA. Giá trị của a và b tương ứng là:
A. 0,1 và 2
B. 1 và 0,2
C. 2 và 0,1
D. 0,2 và 1
Đáp án B
Chú ý: Có H2 nên N O 3 - đã hết; N2O không tác dụng với O2.
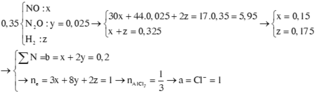
Hỗn hợp X gồm Fe và kim loại M có hóa trị không đổi. Cho 15,2 gam X tác dụng với dung dịch HC1 dư, thấy thoát ra 2,24 lít khí H2 (đktc). Nếu cho lượng X như trên tác dụng với dung dịch HNO3 dư, thu được 4,48 lít khí NO (đktc). Kim loại M là
A. Ag.
B. Cu.
C. Al.
D. Mg.
Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
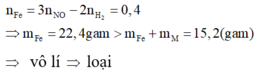
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:

Cho 1,83 gam hỗn hợp 2 kim loại Na và Ba tác dụng với một lượng nước dư, thấy thoát ra 0,448 lít khí H2 đktc. Tổng khối lượng bazơ sinh ra là:
A. 2,1 g
B. 2,15 g
C. 2,51g
D. 2,6 g