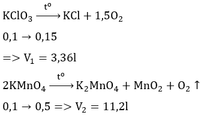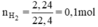Bài 1: Những chất nào trong số những chất sau được dùng để điều chế khí oxi trong phòng thí nghiệm a) Fe_3O_4 b) KCLO_3 c)KMnO_4 d) CaCO_3 e) Không khí g) H_2OBài 2: Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp ? Dẫn ra hai thí dụ để minh họa .Bài 3: Nung đá vôi ( thành phần chính là CaCO_3 ) được vôi sống CaO và khí cacbonic CO_2a, Viết phương trình hóa học của phản ứng.b, Phản ứng nung vôi thuộc loại pahrn ứng hóa học nào ? Vì sao?BÀI 4: TRong phòng thí nghiệm , ng...
Đọc tiếp
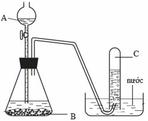
Bài 1: Những chất nào trong số những chất sau được dùng để điều chế khí oxi trong phòng thí nghiệm
a) \(Fe_3O_4\) b) \(KCLO_3\) c)\(KMnO_4\) d) \(CaCO_3\) e) Không khí g) \(H_2O\)
Bài 2: Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp ? Dẫn ra hai thí dụ để minh họa .
Bài 3: Nung đá vôi ( thành phần chính là \(CaCO_3\) ) được vôi sống CaO và khí cacbonic \(CO_2\)
a, Viết phương trình hóa học của phản ứng.
b, Phản ứng nung vôi thuộc loại pahrn ứng hóa học nào ? Vì sao?
BÀI 4: TRong phòng thí nghiệm , người ta điều chế oxit sắt từ \(Fe_3O_4\) baengf cách dùng oxi oxi hóa sắt ở nhiệt độ cao .
a, Tính số gam sắt và số gam khí oxi cần dùng để điều chế được 2,32g oxit sắt từ.
b, Tính số gam kali pemanganat \(KMnO_4\) cần dùng để có được lượng oxi dùng cho phản ứng trên.
Mn giúp với mai phải nộp rồi!