cho 8,8g hỗn hợp Mg và Cu tác dụng với axit H2SO4 đặc nóng thu được khí SO2 duy nhất.
a, tính khối lượng mỗi kim loại hỗn hợp đầu.
b, tính thể tích khí SO2 thu được ở đktc
Câu 6:Cho 18,4 gam hỗn hợp gồm Cu và Fe tác dụng với dung dịch H2SO4 đặc nóng dư thì thu được 7,84 lít khí SO2 (đktc, sản phẩm khử duy nhất) thoát ra. 1. Tính phần trăm khối lượng các kim loại trong hỗn hợp đầu. 2. Tính thể tích dung dịch NaOH 2M tối thiểu cần để hấp thụ hết lượng SO2 thoát ra ở thí nghiệm trên.
1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)
Câu 6:Cho 18,4 gam hỗn hợp gồm Cu và Fe tác dụng với dung dịch H2SO4 đặc nóng dư thì thu được 7,84 lít khí SO2 (đktc, sản phẩm khử duy nhất) thoát ra. 1. Tính phần trăm khối lượng các kim loại trong hỗn hợp đầu. 2. Tính thể tích dung dịch NaOH 2M tối thiểu cần để hấp thụ hết lượng SO2 thoát ra ở thí nghiệm trên. Mong mọi n giúp ạ
\(1) n_{Cu} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 64a + 56b = 18,4(1)\\ n_{SO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\)
Bảo toàn electron :
\(2a + 3b = 0,35.2(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Cu} = \dfrac{0,2.64}{18,4}.100\% = 69,57\%\\ \%m_{Fe} = 100\%-69,57\% = 30,43\%\\ 2) NaOH + SO_2 \to NaHSO_3\\ n_{NaOH} = n_{SO_2} = 0,35(mol)\\ \Rightarrow V_{dd\ NaOH} = \dfrac{0,35}{2} = 0,175(lít)\)
Bài 2: Cho 4,8 gam hỗn hợp Fe và Cu tác dụng vừa đủ với dung dịch H2SO4 đặc nóng thu được 2,24 lít khí SO2 (đktc).
a. Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b. Cho SO2 thu được vào 150 ml dung dịch KOH 1M. Tính khối lượng muối thu được?
a) n Fe = a(mol) ; n Cu = b(mol)
=> 56a + 64b = 4,8(1)
n SO2 = 2,24/22,4 = 0,1(mol)
Bảo toàn e :
3n Fe + 2n Cu = 2n SO2
<=> 3a + 2b = 0,2(2)
Từ (1)(2) suy ra a = b = 0,04
%m Fe = 0,04.56/4,8 .100% = 46,67%
%m Cu = 100% -46,67% = 53,33%
b)
n KOH = 0,15
Ta có :
1 < n KOH / n SO2 = 0,15/0,1 = 1,5 < 2 nên muối sinh ra là Na2SO3(x mol) và NaHSO3(y mol)
2NaOH + SO2 $\to$ Na2SO3 + H2O
NaOH + SO2 $\to$ NaHSO3
Theo PTHH :
n SO2 = a + b = 0,1
n NaOH = 2a + b = 0,15
Suy ra a= 0,05 ; b = 0,05
m muối = 0,05.126 + 0,05.104 = 11,5 gam
Bài 2 :
- Gọi số mol Fe và Cu lần lượt là a, b mol
Ta có : mhh = mFe + mCu = 56a + 64b = 4,8
Bte : 3a + 2b = 0,2
=> a = b =0,04mol
a, Ta có : mFe =n.M = 2,24g ( 46,7% )
=> %Cu = 53,3%
b, Ta thấy sau phản ứng thu được K+, SO3-2 xmol, HSO3- y mol
BtS : x + y = 0,1
BTĐT : 2x + y = 0,15
=> x =y = 0,05 mol
=> mM = mK2SO3 + mKHSO3 = 13,9g
Hoà tan hoàn toàn 17,6 gam hỗn hợp Fe và Cu vào dung dịch axit H2SO4 đặc nóng, dư. Sau phản
ứng thu được 8,96 lit khí SO2 (đo ở đktc) và dung dịch A.
a) Tính % khối lượng của mỗi kim loại trong hỗn hợp ban đầu?
b) Nếu cho lượng khí SO2 thu được ở trên vào 500 ml dd NaOH 1M. Tính nồng độ mol chất trong dd
thu được sau phản ứng? Biết rằng thể tích của dung dịch thay đổi không đáng kể.
c) Cho 500 ml dd BaCl2 1M vào dd A. Sau phản ứng thu được m gan kết tủA. Tính m. Biết rằng lượng
axít dư so với phản ứng là 10%. mọi người giải câu c) dùm em nha các câu trên em làm đc rồi
Cho 8,3 gam hỗn hợp hai kim loại Al và Fe tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất ở đktc). Khối lượng của mỗi kim loại trong hỗn hợp ban đầu lần lượt là
A. 2,7 gam; 5,6 gam
B. 8,1 gam; 0,2 gam
C. 5,4 gam; 2,9 gam
D. 1,35 gam; 6,95 gam
Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
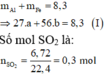
Sơ đồ phản ứng:
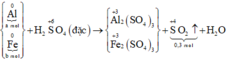
Các quá trình nhường, nhận electron:

Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với H 2 SO 4 đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí SO 2 có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được
A. 6,0 gam.
B. 5,9 gam.
C. 6,5 gam.
D. 7,0 gam.
Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với H2SO4 đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí SO2 có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được
A. 6,0 gam.
B. 5,9 gam.
C. 6,5 gam.
D. 7,0 gam.
Đáp án A
→ n SO 4 2 - ( muoi ) = n SO 2 = 0 , 045
→ m muoi = 1 , 68 + 0 , 045 . 96 = 6
Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với H2SO4 đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí SO2 có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được
A. 6,0 gam.
B. 5,9 gam.
C. 6,5 gam.
D. 7,0 gam.
Chọn đáp án A
2H2SO4 + 2e → SO2 + SO42– + 2H2O ⇒ nSO42– = nSO2 = 0,045 mol.
⇒ mmuối = mKL + mSO42– = 1,68 + 0,045 × 96 = 6(g) ⇒ chọn A.
Cho 33,2g hỗn hợp X gồm Cu, Mg, Al tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hợp X lần lượt là:
A. 13,8;7,6;11,8
B. 11,8;9,6;11,8
C. 12,8;9,6;10,8
D. kết quả khác
Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)