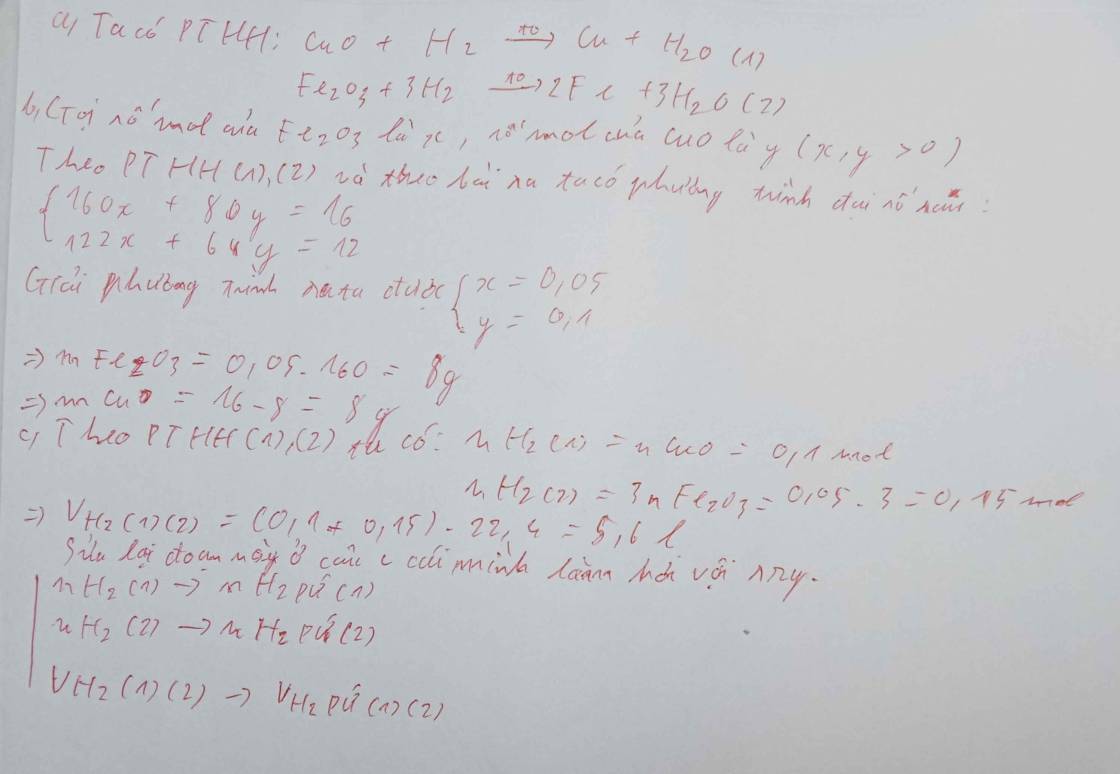dẫn 2,24l H2 (đktc) vào một ống nghiệm chứa 12g CuO đã nung tới nhiệt độ thích hợp PƯ kết thucsc còn lại là a chất rắn.tính a

Những câu hỏi liên quan
7. Dẫn 2,24 lít khí H2 (ở đkc) vào một ống có chứa 12g CuO đã nung nóng tới nhiệt độ thích hợp. Kết thúc phản ứng trong ống còn lại a gam chất rắn. a/ Viết PTHH. b/ Tính khối lượng nước tạo thành sau phản ứng. c/ Tính a.
nCuO=12/80=0,15(mol)
nH2=2,24/22,4=0,1(mol)
a) PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,15/1 > 0,1/1
-> CuO dư, H2 hết => Tính theo nH2
b) Ta sẽ có: nCu= nCuO(p.ứ)=nH2O= nH2=0,1(mol)
=> mH2O=0,1.18=1,8(g)
c) nCuO(dư)=0,15 - 0,1= 0,05(mol)
m(rắn)= mCu + mCuO(dư)= 0,1.64 + 0,05.80= 10,4(g)
=>a=10,4(g)
Đúng 2
Bình luận (0)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{12}{80}=0,15\left(mol\right)\)
a) Pt : H2 + CuO → Cu + H2O\(|\)
1 1 1 1
0,1 0,15 0,1 0,1
b) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\)
⇒ H2 phản ứng hết , CuO dư
⇒ Tính toán dựa vào số mol của H2
b) Số mol của nước
nH2O = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của nước
mH2O = nH2O . MH2O
= 0,1. 18
= 1,8 (g)
Số mol của đồng
nCu = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của đồng
mCu = nCu . MCu
= 0,1 . 64
= 6,4 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (2)
Bài tập 1: Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì ? *Bài tập 2: Dẫn 2,24 lít khí H2 (đktc) vào một ống có chứa 12 gam CuO đã nung nóng tới nhiệt độ thích hợp. Kết thúc phản ứng trong ống nghiệm còn lại a gam chất rắn. a/ Viết phương trình phản ứng. b/ Tính khối lượng nước tạo thành sau phản ứng. c/ Tính a ? GIUP MIK NHE
Đọc tiếp
Bài tập 1: Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì ? *
Bài tập 2: Dẫn 2,24 lít khí H2 (đktc) vào một ống có chứa 12 gam CuO đã nung nóng tới nhiệt độ thích hợp. Kết thúc phản ứng trong ống nghiệm còn lại a gam chất rắn. a/ Viết phương trình phản ứng. b/ Tính khối lượng nước tạo thành sau phản ứng. c/ Tính a ?
GIUP MIK NHE
Dẫn 2,479 lít khí H2 (ở đktc) vào một ống có chứa 12 gam copper (II) oxide (CuO) đã nung nóng tới nhiệt độ thích hợp, sau phản ứng thu được a gam chất rắn và hơi nước.
(a) Viết phương trình hóa học xảy ra.
(b) Tính khối lượng nước tạo thành sau phản ứng.
(c) Tính a.
GIÚP MÌNH VỚI Ạ plssssss
a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
b, \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\), ta được CuO dư.
Theo PT: \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)
c, BTKL, có: mH2 + mCuO = m chất rắn + mH2O
⇒ a = 0,1.2 + 12 - 1,8 = 10,4 (g)
Đúng 1
Bình luận (0)
C1 viết phương trình hóa học biểu diễn sự chảy của sắt,photpho,lưu hình ,nhôm trong khí oxi
C2 dẫn 2,24 lít khí hidro(đktc) vào một ống chứa 12g CuO đã nung nóng đến một nhiệt độ thích hợp.Khối lượng nước tạo thành là:
C3 Cho chất Fe2O3
a) hợp chất Fe2O3 gồm mấy nguyên tố ? đó là nguyên tố nào?
b) Tính phần trăm về khối lượng của oxi
C1:
3Fe + 2O2 -> (t°) Fe3O4
4P + 5O2 -> (t°) 2P2O5
S + O2 -> (t°) SO2
C2:
nH2 = 2,24/22,4 = 0,1 (mol)
nCuO = 12/80 = = 0,15 (mol)
PTHH: CuO + H2 -> (t°) Cu + H2O
LTL 0,15 > 0,1 => CuO dư
nH2O = 0,1 (mol)
mH2O = 0,1 . 18 = 1,8 (g)
C3:
Fe2O3 gồm 2 nguyên tố: Fe và O
%Fe = 112/160 = 70%
%O = 100% - 70% = 30%
Đúng 3
Bình luận (2)
Câu 1: Photpho: 4P + 5O2 (to)-> 2P2O5
Lưu huỳnh: S + O2 (to)-> SO2
Nhôm: 4Al + 3O2 (to)-> Al2O3
Câu 2:
PTHH: \(CuO+H_2=>Cu+H_2O\)
\(nH_2=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(nCuO=\dfrac{12}{80}=0,15\left(mol\right)\)
\(=>CuOdư\)
\(nH_2O=nH_2=0,1\left(mol\right)\)
\(mH_2=0,1\text{×}18=1,8\left(gam\right)\)
Đúng 3
Bình luận (0)
Giúp em giải bài này với ạ mai em kt rồi ạ
Dẫn 2,24 lít khí hidro ở đktc vào 1 ống có chứa 12g bột đồng 2 oxit dc đun nóng ở nhiệt độ thích hợp khi kết thúc phản ứng trong ống nghiệm còn lại A gam chất rắn
a. Tính khối lượng nước tạo thành sau phản ứng
b. Tính A.
![]() chac ban lop 8 ha
chac ban lop 8 ha
pthh: h2+ cuo ---> cu + h2o
nh2=0.1 mol
ncu=0.1875 mol
=> h2 du
=> mh2o=0.185*18= 3.375g
=> mcu(A)=0.185*64=12(g)
Đúng 0
Bình luận (1)
PTHH:H2+CuO → Cu +H2O
Số mol H2:nH2=2.24:22.4=0,1(mol)
Số mol CuO : nCuO=12:80=0,15(mol)
lập tỉ lệ:nH2:nCuO=0.1nhỏ hơn 0,15
→nCuO dư.Chọn nH2 để tính
a)theo pt và đề
Số mol H2O :nH20=nH2=0,1 (mol)
Khối lượng nước tạo thành sau phản ứng :mH2O=0,1.18=1,8g
b)Số mol CuO tham gia:nCuO=nH2=0,1(mol)
Số mol CuO dư:nCuOdư=0,15-0,1=0.05(mol)
Khối lượng CuO dư:mCuOdư=0,05.80=4g
Số mol Cu :nCuO=nH2=0,1(mol)
khối lượng Cu: mCu=0,1.64=6,4g
Vậy mA=mCuOdư+mCu=4+6,4=10,4g
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
dẫn luồng khí H2 đi qua ống đựng 24g CuO nung nóng , sau một thời gian pư thu được 21,6 g chất rắn a, tính hiệu suất pư b, tính thể tích H2 đã tham gia pư (đktc)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\\ Đặt:n_{CuO\left(p.ứ\right)}=a\left(mol\right)\\ \Rightarrow n_{Cu}=a\left(mol\right);m_{CuO\left(dư\right)}=24-80a\left(g\right)\\ \Rightarrow m_{rắn}=m_{CuO\left(dư\right)}+m_{Cu}=\left(24-80a\right)+64a=21,6\\ \Leftrightarrow-16a=-2,4\\ \Leftrightarrow a=0,15\\ Vậy:H=\dfrac{0,15.80}{24}.100\%=50\%\\ b,n_{H_2}=n_{Cu}=a=0,15\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\)
Đúng 3
Bình luận (0)
Hỗn hợp A gồm 3 khí NH3, N2 và H2. Dẫn A vào bình có nhiệt độ cao. Sau khi NH3 phân hủy hoàn toàn thu được hỗn hợp khí B có thể tích tăng 25% so với A. Dẫn B qua ống CuO nung nóng sau đó loại nước thì chỉ còn lại một chất khí có thể tích giảm 75% so với B. Tính % thể tích H2 trong hỗn hợp A? A. 25% B. 75% C. 18,75% D. 56,25%
Đọc tiếp
Hỗn hợp A gồm 3 khí NH3, N2 và H2. Dẫn A vào bình có nhiệt độ cao. Sau khi NH3 phân hủy hoàn toàn thu được hỗn hợp khí B có thể tích tăng 25% so với A. Dẫn B qua ống CuO nung nóng sau đó loại nước thì chỉ còn lại một chất khí có thể tích giảm 75% so với B. Tính % thể tích H2 trong hỗn hợp A?
A. 25%
B. 75%
C. 18,75%
D. 56,25%
Dẫn luồng khí H2 dư đi qua 16g hoá hợp A chứa hai oxit CuO và Fe2O3 nung nóng sau khi hỗn hợp kết thúc thu được 12g hỗn hợp B chứa 2 kim loại Đồng và Sắt a, Viết pthhb,Tính khối lượng mỗi oxit trong hoá hợp A c,Tính thể tích H2 đã dùng ở đktc
Đọc tiếp
Dẫn luồng khí H2 dư đi qua 16g hoá hợp A chứa hai oxit CuO và Fe2O3 nung nóng sau khi hỗn hợp kết thúc thu được 12g hỗn hợp B chứa 2 kim loại Đồng và Sắt
a, Viết pthh
b,Tính khối lượng mỗi oxit trong hoá hợp A
c,Tính thể tích H2 đã dùng ở đktc
vào bình A chứa dung dịch HCl dư, còn lại chất răn B. lượng khí thoát ra được dẫn qua một ống chứa CuO nung nóng, thấy giảm khối lượng của ống 2,72 gam. Thêm vào bình A lượng dư của muối natri, đun nóng nhẹ, thu được 0,896 lít (đktc) một chất khí không màu, hoá nâu trong không khí.
a) Viết phương trình hoá học xảy ra. Xác định muối natri đã dùng.
b) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp.
c) Tính lượng muối natri tối thiểu để hoà tan hết chất rắn B trong bình A.
Đọc tiếp
vào bình A chứa dung dịch HCl dư, còn lại chất răn B. lượng khí thoát ra được dẫn qua một ống chứa CuO nung nóng, thấy giảm khối lượng của ống 2,72 gam. Thêm vào bình A lượng dư của muối natri, đun nóng nhẹ, thu được 0,896 lít (đktc) một chất khí không màu, hoá nâu trong không khí. a) Viết phương trình hoá học xảy ra. Xác định muối natri đã dùng. b) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp. c) Tính lượng muối natri tối thiểu để hoà tan hết chất rắn B trong bình A.