Giúp em vs !!
cho 4,5 gam nhôm (Al) phản ứng hoàn toàn vs dung dịch axit clohidric
a) viết phương trình hoá học say ra
b) Tính thể tích hidro ở điều kiện tiêu chuẩn
c) tính khôi lượng AlCl3 tạo thành sau phản ứng
cho biết Al tác dụng với 58,8g axit sunfuric (H2SO4) thu được nhôm sunfat ( Al2(SO4)3) và khí H2. Viết PTHH và tính khối lượng Al đã phản ứng. Tính khối lượng nhôm sunfat và thể tích khí H2 sinh ra ở điều kiện tiêu chuẩn.
Ta có: \(n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
\(PTHH:2Al+3H_2SO_4--->Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,4 <--- 0,6 -----------> 0,2 --> 0,6
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4.27=10,8\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\\V_{H_2}=0,6.22,4=13,44\left(lít\right)\end{matrix}\right.\)
Cho 14 gam kim loại Fe tan hoàn toàn trong dd axit sunfuric (\(H_2SO_4\))
. a/Viết Phương trình phản ứng xảy ra?
b/Tính thể tích khí hido thoát ra (ở đktc)?
c/Tính khối lượng axit sunfuric cần dùng?
giúp mình với
a) nFe= 0,25(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
0,25______0,25______0,25__0,25(mol)
b) V(H2,đktc)=0,25.22,4=5,6(l)
c) mH2SO4= 0,25.98= 24,5(g)
Lời giải "chi tiết"
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)=n_{H_2SO_4}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4}=0,25\cdot98=24,5\left(g\right)\\V_{H_2}=0,25\cdot22,4=5,6\left(l\right)\end{matrix}\right.\)
a,PTHH:Fe+H2SO4→FeSO4+H2↑
b, Ta có: nFe= \(\dfrac{14}{56}\)=0,25(mol)
Theo pt: nH2=nFe=0,25(mol)
⇒VH2=0,25.22,4=5,6(l)
c, Theo pt: nH2SO4=nFe=0,25(mol)
⇒mH2SO4=0,25.98=24,5(g)
Cho kẽm phản ứng hoàn toàn với dung dịch axit clohidric thu được 5,6 lit khí hidro ở điều kiện tính chất a)viết phương trình hoá học b)tính khối lượng axit đã dùng c)nếu dùng toàn bộ lượng hidro thu được ở trên đem khử 12g bột CuO ở nhiệt độ cao,thì sau khi phản ứng kết thúc thu được bao nhiêu gam Cu? Giúp với mai thi rồi😿
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(.........0.5............0.25\)
\(m_{HCl}=0.5\cdot36.5=18.25\left(g\right)\)
\(n_{CuO}=\dfrac{12}{80}=0.15\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(1...........1\)
\(0.15.........0.25\)
\(LTL:\dfrac{0.15}{1}< \dfrac{0.25}{1}\Rightarrow H_2dư\)
\(n_{Cu}=n_{CuO}=0.15\left(mol\right)\)
\(m_{Cu}=0.15\cdot64=9.6\left(g\right)\)
a) Zn + 2HCl $\to$ ZnCl2 + H2
b) n H2 = 5,6/22,4 = 0,25(mol)
Theo PTHH :
n HCl = 2n H2 = 0,5(mol)
m HCl = 0,5.36,5 = 18,25(gam)
c) CuO + H2 $\xrightarrow{t^o}$ Cu + H2O
Ta có :
n CuO = 12/80 = 0,15 < n H2 = 0,25 => H2 dư
Theo PTHH :
n Cu = n CuO = 0,15 mol
=> m Cu = 0,15.64 = 9,6 gam
Cho 10 g Fe vào dung dịch HNO3 loãng dư thu được sản phẩm khử NO duy nhất. Sau khi phản ứng xảy ra hoàn toàn, còn dư 1,6g Fe. Thể tích NO thoát ra ở điều kiện tiêu chuẩn là:
A. 2,24
B. 3,36
C. 4,48
D. 11,2
Đáp án A
mFe phản ứng = 10 -1,6 = 8,4g
![]()
Do Fe dư nên sau khi Fe bị HNO3 oxi hóa thành Fe3+ thì toàn bộ Fe3+ lại bị khử thành Fe2+ nên có phản ứng:
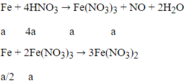
Ta có:

⇒VNO = 0,1.22,4 = 2,24 lít
Hòa tan hoàn toàn 5,4 gam Al bằng vừa đủ 200ml dung dịch HCl
a, Viết phương trình hóa học cho phản ứng trên
b, Tính thể tích khí Hidro sinh ra ở đktc
c, Tính nồng độ mol của dung dịch HCl đã phản ứng.
đ, Nếu dung toàn bộ lượng hiđrô bay ra ở trên đem khử 12g bột CuO ở nhiệt độ cao. Tính khối lượng kim loại tạo thành
nAl = \(\dfrac{5,4}{27}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2 mol-> 0,6 mol----------> 0,3 mol
VH2 sinh ra = 0,3 . 22,4 = 6,72 (lít)
CM HCl đã dùng = \(\dfrac{0,6}{0,2}=3M\)
nCuO = \(\dfrac{12}{80}=0,15\) mol
Pt: CuO + H2 --to--> Cu + H2O
0,15 mol-------------> 0,15 mol
Xét tỉ lệ mol giữa CuO và H2:
\(\dfrac{0,15}{1}< \dfrac{0,3}{1}\)
Vậy H2 dư
mCu tạo thành = 0,15 . 64 = 9,6 (g)
cho 13,5 gam nhôm tác dụng vs HCl theo phản ứng sau Al + HCl -> AlCl3 + H2
a, lập Phương trình phản ứng
b, xác định tỷ lệ các chất của phản ứng
c, Tính thể tích H2 sinh ra ở ( ĐKTC )
a)
\(2Al + 6HCl \to 2AlCl_3 + 3H_2 \)
b)
Tỉ lệ số nguyên tử Al : số phân tử HCl : số phân tử AlCl3 : số phân tử H2 là 2 : 6 : 2 : 3
c)
Ta có : \(n_{Al} = \dfrac{13,5}{27} = 0,5(mol)\)
Theo PTHH : \(n_{H_2} = \dfrac{3}{2}n_{Al} = 0,75(mol)\\ \Rightarrow V_{H_2} = 0,75.22,4 = 16,8(lít)\)
Trong phòng thí nghiệm ,người ta điều chế Hydrogen bằng cách cho Zine tác dụng với dung dịch Hydrochloric acid.A)Viết phương trình hóa học biểu diễn phản ứng điều chế trên.B)Tính thể tích hydrogen thu được ở đktc,nếu hòa tan hoàn toàn 7,89g Zine.C)Tính khối lượng nước thu được khi đốt cháy lượng khí hydrogen trên bằng 5,6l không khí (đktc)(biết Oxygen chiếm 1/5 thể tích không khí)
A) Phương trình hóa học:
Zn + 2HCl→ZnCl2 + H2
B) nZn=\(\dfrac{7,89}{65}\)= ??? (số nó cứ bị sao sao ấy, bạn xem lại khối lượng Kẽm xem có sai không nhé)
đến đây thì mình khá ? bởi vì Zine là chất gì thì nghĩ là Zinc mà Zinc là Kẽm nên đó.
Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai este đồng phân cần dùng 27,44 lít khí O2, thu được 23,52 lít khí CO2 và 18,9 gam H2O. Nếu cho m gam X tác dụng hết với 400ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thì thu được 27,9 gam chất rắn khan, trong đó có a mol muối Y và b mol muối Z (MY < MZ). Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Tỉ lệ a : b là
A. 3 : 5.
B. 4 : 3.
C. 2 : 3
D. 3 : 2.
Chọn B.
Theo đề ta có: n O 2 = 1 , 225 ; n C O 2 = 1 , 05 v à n H 2 O = 1 , 05 => X no, đơn chức, mạch hở (vì n C O 2 = n H 2 O )
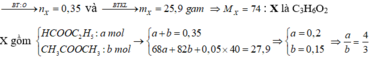
Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai este đồng phân cần dùng 27,44 lít khí O2, thu được 23,52 lít khí CO2 và 18,9 gam H2O. Nếu cho m gam X tác dụng hết với 400ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thì thu được 27,9 gam chất rắn khan, trong đó có a mol muối Y và b mol muối Z (MY < MZ). Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Tỉ lệ a : b là
A. 3 : 5
B. 4 : 3
C. 2 : 3
D. 3 : 2