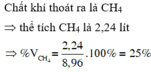Cho 3 lít hỗn hợp etylen và metan (đo ở đktc) đi qua dung dịch nước brom nhạt màu thu được 1.7g đibrometan. Xác định thành phần % về thể tích mỗi khí trong hỗn hợp đầu.

Những câu hỏi liên quan
Cho 0,448 lít hỗn hợp khí gồm metan và etilen đi qua dung dịch brom dư, thấy dung dịch nhạt màu và còn 0,112 lít khí thoát ra. Biết các thể tích khí đo ở đktc, thành phần % thể tích khí metan có trong hỗn hợp là
A. 25%
B. 50%.
C. 60%.
D. 37,5%.
- Do dung dịch brom dư, nên khí thoát ra là metan.
![]()
- Chọn đáp án A.
Đúng 0
Bình luận (0)
Câu 3: Cho 5,6 lít hỗn hợp metan và etilen (đo ở đktc) đi qua dung dịch brom, người ta thu được 4,7 gam đibrometan (C2H4Br2).a. Viết phương trình hóa học.b. Tính thể tích của mỗi khí trong hỗn hợp ban đầu
Đọc tiếp
Câu 3: Cho 5,6 lít hỗn hợp metan và etilen (đo ở đktc) đi qua dung dịch brom, người ta thu được 4,7 gam đibrometan (C2H4Br2).
a. Viết phương trình hóa học.
b. Tính thể tích của mỗi khí trong hỗn hợp ban đầu
a) \(n_{C_2H_4Br_2}=\dfrac{4,7}{188}=0,025\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,025<------------0,025
b) \(\left\{{}\begin{matrix}V_{C_2H_4}=0,025.22,4=0,56\left(l\right)\\V_{CH_4}=5,6-0,56=5,04\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Câu 30. Cho 4 lít hỗn hợp etilen và metan ở đktc vào dung dịch brôm, dung dịch brom nhạt màu dần. Sau phản ứng người ta thu được 18,8 g đi brom etan.a) Tính khối lượng brôm tham gia phản ứng ?b) Xác định thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ? c) Tính thể tích không khí cần để đốt cháy hết hỗn hợp khí trên, biết khí oxi chiếm 1/5 thể tích không khí.
Đọc tiếp
Câu 30. Cho 4 lít hỗn hợp etilen và metan ở đktc vào dung dịch brôm, dung dịch brom nhạt màu dần. Sau phản ứng người ta thu được 18,8 g đi brom etan.
a) Tính khối lượng brôm tham gia phản ứng ?
b) Xác định thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ?
c) Tính thể tích không khí cần để đốt cháy hết hỗn hợp khí trên, biết khí oxi chiếm 1/5 thể tích không khí.
a) \(n_{C_2H_4Br_2}=\dfrac{18,8}{188}=0,1\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,1<----0,1<---0,1
=> \(m_{Br_2}=0,1.160=16\left(g\right)\)
b)
\(\%V_{C_2H_4}=\dfrac{0,1.22,4}{4}.100\%=56\%\)
=> \(\%V_{CH_4}=100\%-56\%=44\%\)
c) \(n_{CH_4}=\dfrac{4.44\%}{22,4}=\dfrac{11}{140}\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
\(\dfrac{11}{140}\)-->\(\dfrac{11}{70}\)
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,1---->0,3
=> \(V_{O_2}=\left(\dfrac{11}{70}+0,3\right).22,4=10,24\left(l\right)\)
=> Vkk = 10,24.5 = 51,2 (l)
Đúng 3
Bình luận (0)
Cho 2,24 lít (đktc) hỗn hợp khí axetilen và metan vào dung dịch brom, dung dịch brom bị nhạt màu. Sau phản ứng khối lượng dung dịch tăng 1,3g.
1. Tính khối lượng brom tham gia phản ứng.
2. Xác định thành phần % về thể tích của mỗi khí trong hỗn hợp. (cho O=16, C=12, H=1)
Cho 3l hỗn hợp etilen và metan ( đktc) vào dung dịch Br2, thấy dung dịch bị nhạt màu thu được 1,7g Đibrometan a , Tính khối lượng Br2 tham gia phản ứng b, xác định thành phần phần trăm thể tích hỗn hợp đầu
\(n_{C_2H_4Br_2}=\dfrac{1,7}{188}=\dfrac{17}{1880}\left(mol\right)\\C_2H_4+Br_2\rightarrow C_2H_4Br_2 \\ \Rightarrow n_{C_2H_4}=n_{C_2H_4Br_2}=n_{Br_2}=\dfrac{17}{1880}\left(mol\right)\\ a,m_{Br_2}=\dfrac{17}{1880}.160=\dfrac{68}{47}\left(g\right)\\ b,\%V_{C_2H_4}=\dfrac{\dfrac{17}{1880}.22,4}{3}.100\approx6,752\%\Rightarrow\%V_{CH_4}\approx93,248\%\)
Đúng 4
Bình luận (0)
a)C2H4 + Br2 -> C2H4Br2
nC2H4Br2 = 1,7/ 188= 0,009(mol)
→ nBr2 =0,009 (mol)
→ mBr2= 1,44 g nhé
Đúng 2
Bình luận (0)
Cho 11 lit hỗn hợp khí gồm metan và etylen ở đktc đi qua bình đựng 250ml dung dịch brom 1,5M, nhận thấy dung dịch brom mất màu. Tính thể tích và phần trăm thể tích mỗi khí trong hỗn hợp ban đầu. Tính khối lượng chât tan có trong dung dịch sau phản ứng.
Cho hỗn hợp qua dung dịch brom chỉ có etylen tác dụng.
\(n_{Br_2}=0,25\cdot1,5=0,375mol\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,375 0,375
\(V_{C_2H_4}=0,375\cdot22,4=8,4l\Rightarrow V_{CH_4}=11-8,4=2,6l\)
Đúng 2
Bình luận (0)
cho 4 lít hỗn hợp khí etylen và metan vào dung dịch brom, dd brom nhạt màu dần. Sau phản ứng ta thu được 18,8g đibrometan. Biết các khí đo ở đktc
a. viết PTHH
b. xác định phần trăm về thể tích của mỗi khí trong hỗn hợp
nC2H4Br2= 0.1 (mol)
C2H4 + Br2 --> C2H4Br2
nC2H4= 0.1 (mol)
VC2H4= 2.24l
VCH4= 4-2.24=1.76l
%CH4= 44%
%C2H4= 56%
Đúng 1
Bình luận (0)
cho 4 lít hỗn hợp khí etylen và metan vào dung dịch brom, dd brom nhạt màu dần. Sau phản ứng ta thu được 18,8g đibrometan. Biết các khí đo ở đktc
a. viết PTHH
b. xác định phần trăm về thể tích của mỗi khí trong hỗn hợp
Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều đo ở đktc). Thành phần phần trăm thể tích của metan trong X là A. 25,0% B. 50,0% C. 60,0% D. 37,5%
Đọc tiếp
Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều đo ở đktc). Thành phần phần trăm thể tích của metan trong X là
A. 25,0%
B. 50,0%
C. 60,0%
D. 37,5%