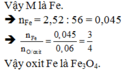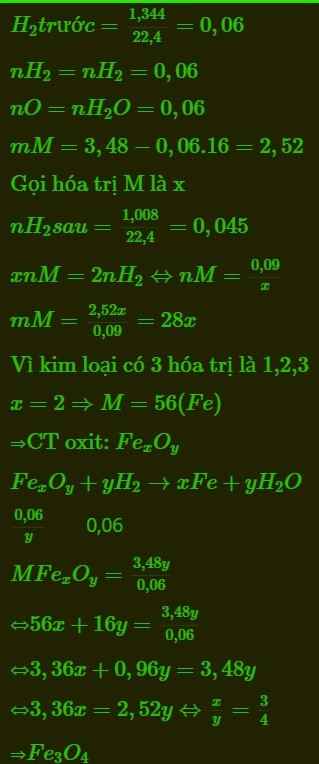Khử hết 3,48 gam một oxit của kim loại R cần 1,344 lit \(H_2\) (đktc). Tìm công thức oxit.

Những câu hỏi liên quan
Khử hết 3,48 gam một oxit của kim loại R cần 1,344 lit H2 (đktc). Tìm công thức oxit.
Gọi CT của oxit là R2On(n là hóa trị của R)
có : nH2=1,344/22,4=0,06(mol)
R2On+nH2→2R+nH2O
Theo phương trình trên , ta có :
nR2On=1/n.nH2=0,06/n(mol)
⇒mR2On=0,06/n.(2R+16n)=3,48(gam)
⇒R=21n
Nếu n=1 thì R=21(loại)
Nếu n=2nthì R=42(loại)
Nếu n=3thì R=63(loại)
Nếu n=8/3 thì R=56(Fe)
Ta có Fe:O=2:8/3=3:4
Vậy CT của oxit cần tìm là Fe3O4
Đúng 1
Bình luận (0)
Gọi x là hóa trị của R
Gọi CTHH của R là R2On
Ta có: nH2= 1,344/22,4= 0,06(mol)
PTHH: R2On + nH2 → 2R + nH2O.
Theo PT trên, ta có: R/n = 21.
- Nếu n = 1 thì R = 21 (loại)
- Nếu n = 2 thì R = 42 (loại)
- Nếu n = 3 thì R = 63 (loại)
- Nếu n = 8/3 thì R = 56 (TM) (Fe)
Ta có: \(\dfrac{Fe}{O}\)=\(\dfrac{2}{\dfrac{8}{3}}\) = \(\dfrac{3}{4}\)
=> CTHH của oxit cần tìm là Fe3O4
Đúng 0
Bình luận (0)
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít
H
2
(đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là A.
F
e
3
O
4
B.
F
e
2
O
3
C.
F
e
O
D.
Z...
Đọc tiếp
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H 2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
A. F e 3 O 4
B. F e 2 O 3
C. F e O
D. Z n O
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít
H
2
(đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít
H
2
(đktc). Công thức oxit là A. Fe3O4 B. Fe2O3 C. FeO D. ZnO
Đọc tiếp
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H 2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H 2 (đktc). Công thức oxit là
A. Fe3O4
B. Fe2O3
C. FeO
D. ZnO

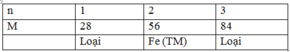
Ta có bảng sau:
n |
1 |
2 |
3 |
4 |
M |
21 (loại) |
42 (loại) |
63 (loại) |
84 (loại) |
=> loại trường hợp này

Đúng 0
Bình luận (0)
Khử 3,48 gam một oxit kim loại M cần dùng 1,344 lít khí hiđro (ở đktc). Toàn bộ lượng kim loại thu được tác dụng với dung dịch HCl dư cho 1,008 lít khí hiđro (ở đktc). Xác định kim loại M và công thức hóa học của oxit trên?
CTHH: AxOy
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
PTHH: AxOy + yH2 --to--> xA + yH2O
\(\dfrac{0,06}{y}\)<--0,06---->\(\dfrac{0,06x}{y}\)
2A + 2nHCl --> 2ACln + nH2
\(\dfrac{0,06x}{y}\)---------------->\(\dfrac{0,03xn}{y}\)
=> \(\dfrac{0,03xn}{y}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\)
=> \(\dfrac{y}{x}=\dfrac{2}{3}n\)
\(M_{A_xO_y}=\dfrac{3,48}{\dfrac{0,06}{y}}=58y\left(g/mol\right)\)
=> \(x.M_A=42y\)
=> \(M_A=\dfrac{42y}{x}=28n\left(g/mol\right)\)
Xét n = 2 thỏa mãn => MA = 56 (g/mol)
=> A là Fe
\(\dfrac{x}{y}=\dfrac{3}{2n}=\dfrac{3}{4}\) => CTHH: Fe3O4
Đúng 4
Bình luận (0)
Khử 3,48 g một oxit của kim loại M cần dùng 1,344 lít H2(đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là : A. Fe3O4. B. Fe2O3. C. FeO. D. ZnO.
Đọc tiếp
Khử 3,48 g một oxit của kim loại M cần dùng 1,344 lít H2(đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là :
A. Fe3O4.
B. Fe2O3.
C. FeO.
D. ZnO.
Khử 3,48 g một oxit của kim loại M cần dùng 1,344 lít H2(đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là :
Giúp em bài này với ạ !!!
khử 3,48 gam oxit một kim loại M cần dùng 1,344 lít H2(đktc). Toàn bộ lượng kim loại thu được cho tác dụng với dd HCl dư thu được 1,008 lít H2(đktc). Xác định M và oxit của nó.
Đặt a là hoá trị kim loại M cần tìm (a: nguyên, dương)
\(M_2O_a+aH_2\rightarrow\left(t^o\right)2M+aH_2O\left(1\right)\\ 2M+2aHCl\rightarrow2MCl_a+aH_2\left(2\right)\\Ta.có:n_{H_2\left(2\right)}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\\ n_{H_2\left(1\right)}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\\ \Rightarrow n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2\left(1\right)}=0,06\left(mol\right)\\ \Rightarrow m_M=3,48-0,06.16=2,52\left(g\right)\\ n_{H_2\left(2\right)}=0,045\left(mol\right)\\ \Rightarrow n_{M\left(2\right)}=\dfrac{0,045.2}{a}=\dfrac{0,09}{a}\left(mol\right)\\ \Rightarrow M_M=\dfrac{2,52}{\dfrac{0,09}{a}}=28a\left(\dfrac{g}{mol}\right)\)
Xét các TH: a=1; a=2; a=3; a=8/3 thấy a=2 thoả mãn khi đó MM=56(g/mol), tức M là Sắt (Fe=56)
Đặt CTTQ của oxit sắt cần tìm là FemOn (m,n: nguyên, dương)
\(n_{Fe}=\dfrac{2,52}{56}=0,045\left(mol\right)\\n_O=0,06\left(mol\right)\)
=> m:n= 0,045:0,06=3:4
=>m=3;n=4
=> CTHH oxit: Fe3O4 (Sắt từ oxit)
Đúng 1
Bình luận (2)
9. Khử 3,48 gam oxit một kim loại M cần dùng 1,344 lít CO (đktc). Toàn bộ lượng kim loại thu được cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Xác định kim loại M và oxit của nó.
Gọi CT oxit là M2Om
Mol H2 TN1=0,06 mol
Mol H2 TN2=0,045 mol
M2Om + mH2→ 2M + mH2O
0,06/m mol<=0,06 mol. =>0,12/m mol
=>0,06(2M+16m)/m=3,48
2M + 2nHCl→ 2MCln + nH2
0,12/m mol. 0,045 mol
⇒⇒0,045.2/n=0,12/m⇒⇒m=8/3; n=2 tm
Thay m=8/3 vào công thức tính m có M=56 FeFe
Oxit là Fe3O4 vì n=8/3
Đúng 1
Bình luận (10)
Khử 3,48 g một oxit kim loại M, cần dùng 1,344 lít \(H_2\)(đktc). Dùng toàn bộ kim loại M trên tác dụng với \(HCl_{dư}\), cho 1,008 lít \(H_2\) (đktc). Tìm CTHH của oxit kim loại.
Xét phương trình: \(M_xO_y+H_2\rightarrow M+H_2O\)
Bảo toàn khối lượng và \(H_2\) ta có:
\(n_{H_2O}=n_{H_2}=0,06\)
\(\Rightarrow m_M=3,46+0,06.2-0,06.18=2,52\left(g\right)\)
Khi cho M phản ứng với HCl ta có \(n_{H_2}=0,045\)
Xét M chỉ có hóa trị 2,3 nên dễ thấy với hóa trị 2 thì:
\(n_M=n_{H_2}=0,045\Rightarrow M=\frac{2,52}{0,045}=56=Fe\)
Ta có \(\frac{n_M}{n_O}=\frac{0,045}{0,06}=\frac{3}{4}\)
\(\Rightarrow\) CT của oxit là: \(Fe_3O_4\)
Đúng 0
Bình luận (0)