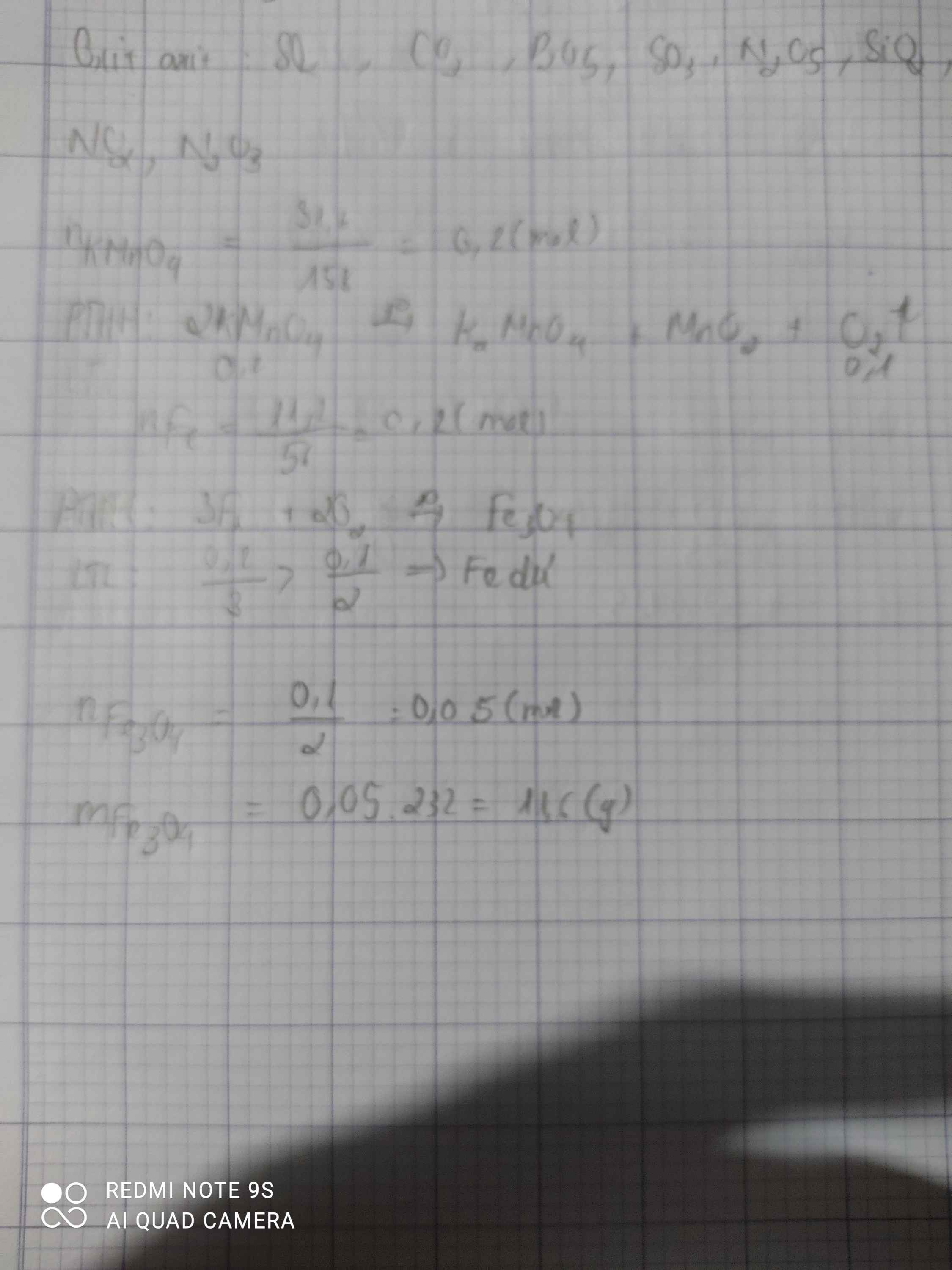tính lượng KMNO4 dùng để điều chế O2 đủ đốt hêt vơi 11,2g Fe

Những câu hỏi liên quan
Đốt hoàn toàn 4,17g hỗn hợp Al,Fe thu đc 6,17 hỗn hợp 2 oxit a) tính khối lượng KMnO4 cần dùng để điều chế O2 đủ cho phản ứng trên b) Tính %Al,%Fe
\(a.n_{Al}=a;n_{Fe}=b\left(mol\right)\\ m_{hh}=27a+56b=4,17\left(1\right)\\ 4Al+3O_2\underrightarrow{t^{^{ }0}}2Al_2O_3\\ 3Fe+2O_2\underrightarrow{t^{^{ }0}}Fe_3O_4\\ m_{oxit}=\dfrac{1}{2}\cdot102a+\dfrac{1}{3}\cdot232b=6,17\left(2\right)\\ \left(1\right)\left(2\right)\Rightarrow a=0,03;b=0,06\\ \Rightarrow n_{O_2}=\dfrac{3}{4}a+\dfrac{2}{3}b=0,0625mol\\ 2KMnO_4\underrightarrow{t^{^{ }0}}K_2MnO_4+MnO_2+O_2\\ n_{KMnO_4}=2n_{O_2}=0,125mol\\ m_{KMnO_4}=0,125\cdot158=19,75g\\ b.\%m_{Al}=\dfrac{0,03\cdot27}{4,17}.100\%=19,42\%\\ \%m_{Fe}=80,58\%\)
Đúng 1
Bình luận (0)
Nhiệt phân hoàn toàn 31,6g KMnO4 để điều chế khí oxi trong phòng thí nghiệm
a. Tính thể tích khí oxi thu được ở đktc?
b. Đốt cháy 11,2g Fe với lượng khí O2 thu được ở trên. Tính khối lượng Fe từ oxi thu được sau phản ứng
a.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(PTHH:2KMnO_4\underrightarrow{np}K_2MnO_4+MnO_2+O_2\)
2 1 1 1 ( mol )
0,2 0,1
\(V_{O_2}=n.22,4=0,1.22,4=2,24l\)
b.\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
3 2 1 ( mol )
0,2 0,1
0,1 0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n.M=0,05.232=11,6g\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 5,4g Là trong khí O2 a) tính thể tích khí O2 cần dùng b) Tính số gam KMnO4 cần dùng để điều chế lượng O2 trên
Có lẽ đề cho "Đốt cháy hoàn toàn 5,4 g Al" bạn nhỉ?
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Đúng 1
Bình luận (3)
đốt cháy 11,2g sắt trong õi tạo thành oxit sắt từ
a) viết pthh
b)cần dùng bao nhiêu lít oxi ở đktc để được phản ứng với lượng sắt trên
c)tính khối lượng KMnO4 cần để điều chế lượng oxi nói trên
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.2.......\dfrac{2}{15}\)
\(V_{O_2}=\dfrac{2}{15}\cdot22.4=2.987\left(l\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{4}{15}..............................\dfrac{2}{15}\)
\(m_{KMnO_4}=\dfrac{4}{15}\cdot158=42.13\left(g\right)\)
Đúng 1
Bình luận (0)
a) PTHH: 3 Fe + 2 O2 -to-> Fe3O4
b) nFe=0,2(mol) -> nO2= 2/3. 0,2= 2/15 (mol)
=> V(O2,đktc)=22,4. 2/15 \(\approx\) 2,987(l)
c) 2 KMnO4 -to-> K2MnO4 + MnO2 + O2
nKMnO4= 2/15. 2= 4/15(mol)
=>mKMnO4=4/15 x 158 \(\approx\) 42,133(g)
Đúng 0
Bình luận (0)
Tính khối lượng KMnO4 cần thiết để điều chế một lượng O2 đủ để đốt cháy hết hỗn hợp 1.2 gam C và 4 gam S?
Xem chi tiết
\(n_C=\dfrac{1.2}{12}=0.1\left(mol\right)\\ n_S=\dfrac{4}{32}=0.125\left(mol\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(C+O_2\underrightarrow{t^0}CO_2\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(\sum n_{O_2}=n_C+n_S=0.1+0.125=0.225\left(mol\right)\)
\(\Rightarrow n_{KMnO_4}=2n_{O_2}=0.225\cdot2=0.45\left(mol\right)\)
\(m_{KMnO_4}=0.45\cdot158=71.1\left(g\right)\)
Đúng 1
Bình luận (0)
2KMnO4 -to>K2MnO4+O2+MnO2
0,45------------------------0,225
C+O2-to>CO2
0,1--0,1
S+O2-to>SO2
0,125-0,125
n C=1,2\12=0,1 mol
n S=4\32=0,125 mol
=>m KMnO4=0,45.158=77,1g
Đúng 0
Bình luận (0)
3. Đốt cháy hoàn toàn 5,4g nhôm. Tính : a. thể tích khí O2 (đktc) cần dùng ? b. số gam KMnO4 cần dùng để điều chế lượng khí O2 trên ?
PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,15\left(mol\right)\\n_{KMnO_4}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\\m_{KMnO_4}=0,3\cdot158=47,4\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
bài 4: đốt cháy hoàn toàn 5,4g nhôm. Tính :
a) thể tích O2(đktc) cần dùng ?
b) số gam kMnO4 cần dùng để điều chế lượng khí O2 trên
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(0.2..........0.15\)
\(V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.3...............................................0.15\)
\(m_{KMnO_4}=0.3\cdot158=47.4\left(g\right)\)
Đúng 4
Bình luận (0)
5. Đốt cháy hoàn toàn 2,7g nhôm. Tính :
a) Thể tích khí O2 (đktc) cần dùng?
b) Số gam KMnO4 cần dùng để điều chế lượng khí O2 trên?
a) PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
Ta có: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(\Rightarrow n_{O_2}=0,075\left(mol\right)\) \(\Rightarrow V_{O_2}=0,075\cdot22,4=1,68\left(l\right)\)
b) PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Theo PTHH: \(n_{KMnO_4}=2n_{O_2}=0,15\left(mol\right)\) \(\Rightarrow m_{KMnO_4}=0,15\cdot138=23,7\left(g\right)\)
Đúng 5
Bình luận (5)
a, nAl = 2,7 : 27 = 0,1 mol
PTHH : 4Al + 3O2 -> 2Al2O3
0,1mol -->0,075mol
=> \(V_{O_2}\) cần dùng = 0,075 . 22,4 = 1,68 lít (đktc)
Đúng 0
Bình luận (0)
b, PTHH : 2KMnO4 -> K2MnO4 + MnO2 + O2
0,15 mol <-- 0,075mol
=> \(m_{KMnO_4}\) cần dùng = 0,15 . ( 39 + 55 + 16 . 4 ) = 23,7 gam
Đúng 0
Bình luận (2)
a) Để điều chế cùng lượng O2, ta dùng kclo3 hay kmno4 chất nào lợi hơn, vì sao? b) Để điều chế 11,2 lít O2(đktc) .Tính khối lượng kclo3, kmno4 đã dùng
PTHH :
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
1/3 0,5
\(2MnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
1 0,5
Vậy khi điều chế cùng lượng O2 ta dùng KClO3 lợi hơn vì với 1 mol KClO3 sẽ cho ra 1,5 mol O2 còn KMnO4 chỉ cho ra 0,5 mol O2
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(m_{KClO_3}=122,5.\dfrac{1}{3}=\dfrac{245}{6}\approx40,8\left(g\right)\)
\(m_{KMnO_4}=158.1=158\left(g\right)\)
Đúng 1
Bình luận (0)