Đốt cháy 1,5 gam một hidrocacbon X thu được 2,24 lít CO2 (đktc) và một lượng hơi nước. Xác định công thức cấu tạo của A biết MA = 30 g/mol.

Những câu hỏi liên quan
đốt cháy hoàn toàn 7,2 gam hợp chất hữu cơ X thu được 11,2 lít CO2 và 10,8 gam nước. Biết rằng X có khối lượng mol là 72 (g/mol)
a) xác định công thức phân tử của X
b)viết tất cả các công thức cấu tạo có thể của X
a, \(n_{CO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\Rightarrow n_H=0,6.2=1,2\left(mol\right)\)
Ta có: mC + mH = 0,5.12 + 1,2.1 = 7,2 (g)
→ X chỉ gồm C và H.
Gọi CTPT của X là CxHy.
⇒ x:y = 0,5:1,2 = 5:12
→ CTPT của X có dạng là (C5H12)n
Mà: MX = 72 (g/mol)
\(\Rightarrow n=\dfrac{72}{12.5+2.12}=1\)
Vậy: X là C5H12.
b, CTCT: CH3CH2CH2CH2CH3
CH3CH(CH3)CH2CH3
CH3C(CH3)2CH3
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 2.25 gam một chất hữu cơ X thu được 3.36 lít khí co2(đo ở đktc) và 4.05 gam h2o
a)Chất X có những nguyên tố nào?
b)xác định công thức phân tử và viết công thức cấu tạo của X.Biết khối lượng mol của X nhỏ hơn 40gam/mol
a) Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{4,05}{18}=0,45\left(mol\right)\)
Xét mC + mH = 0,15.12 + 0,45 = 2,25 (g)
=> X gồm C và H
b, CTPT của X có dạng CxHy
=> x : y = 0,15 : 0,45 = 1 : 3
=> (CH3)n < 40
=> n = 2
CTPT: C2H6
Đúng 4
Bình luận (0)
Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{3,36}{22,4}=0,15mol\)
Bảo toàn H: \(n_H=2.n_{H_2O}=2.\dfrac{4,05}{18}=0,45mol\)
\(n_O=\dfrac{2,25-\left(0,15.12+0,45.1\right)}{16}=0mol\)
=> X chỉ có C và H
\(CTHH:C_xH_y\)
\(\rightarrow x:y=0,15:0,45=1:3\)
\(\rightarrow CTPT:CH_3\)
\(CTĐG:\left(CH_3\right)n< 40\)
\(\rightarrow n=1;2\)
\(n=1\rightarrow CTPT:CH_3\left(loại\right)\)
\(n=2\rightarrow CTPT:C_2H_6\left(nhận\right)\)
\(CTCT:CH_3-CH_3\)
Đúng 4
Bình luận (0)
\(X+O_2\underrightarrow{t^o}CO_2+H_2O\)
=> X gồm có nguyên tố C , H.
\(nCO_2=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> nC = 0,15(mol)
mC = 0,15 .12 = 1,8(g)
\(nH_2O=\dfrac{4,05}{18}=0,225\left(mol\right)\)
=> nH = 0,225 . 2 = 0,45(mol)
mH = 0,45 . 1 = 0,45 (g)
Vì mH + mC = 1,8 + 0,45 = 2,25 (g) = mX
=> X không có nguyên tố O.
Gọi CTHH đơn giản của X là CxHy
ta có : x : y = 0,15 : 0,45 = 1 : 3
=> CTHH đơn giản của X là CH3
ta có:
(CH3)n < 40
=> n = 2
=> CTPT của X là C2H6
CTCT của X là CH3 - CH3
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 3 gam chất A, thu được 2,24 lít CO2 (ở đktc) và 1,8 gam nước. Tỷ khối hơi của A so với metan là 3,75. Công thức cấu tạo của A biết A tác dụng được với NaHCO3 tạo khí là A. HCOOCH3. B. CH3COOH. C. HCOOH. D. C2H5COOH
Đọc tiếp
Đốt cháy hoàn toàn 3 gam chất A, thu được 2,24 lít CO2 (ở đktc) và 1,8 gam nước. Tỷ khối hơi của A so với metan là 3,75. Công thức cấu tạo của A biết A tác dụng được với NaHCO3 tạo khí là
A. HCOOCH3.
B. CH3COOH.
C. HCOOH.
D. C2H5COOH
Lời giải
nCO2 = 0,1 mol; nH2O = 0,1 mol
=> mC = 1,2 gam; mH = 0,2 gam
Bảo toàn khối lượng của axit: maxit = mC + mH + mO => mO = 1,6 gam
=> nC : nH : nO = 0,1 : 0,2 : 0,1 = 1 : 2 : 1 => CTPT có dạng CnH2nOn
MA = 3,75.16 = 60 => n = 2
=> CTPT: C2H4O2
Vì A tác dụng với NaHCO3 tạo khí => A là axit CH3COOH
Chọn B
Đúng 0
Bình luận (0)
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít
O
2
. Sản phẩm thu được chỉ gồm có 1,80 g
H
2
O
và 2,24 lít
C
O
2
. Các thể tích khí đo ở đktc.1. Xác định công thức đơn giản nhất của A.2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.3. Xác định công thức cấu tạo có thể có của chất A, ghi...
Đọc tiếp
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít O 2 . Sản phẩm thu được chỉ gồm có 1,80 g H 2 O và 2,24 lít C O 2 . Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
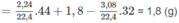
Khối lượng C trong 1,8 g A là: 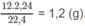
Khối lượng H trong 1,8 g A là: 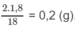
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
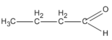 (butanal)
(butanal)
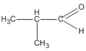 (2-metylpropanal)
(2-metylpropanal)
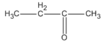 (butan-2-ol)
(butan-2-ol)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 7,2 gam hợp chất hữu cơ X thu được 11,2 lít CO2 (đktc) và 10,8 gam nước. Biết rằng 7,2 gam X có số mol bằng số mol của 3,2 gam khí oxi.
a) Xác định công thức phân tử của X.
b) Viết tất cả các công thức cấu tạo có thể có của X.
Đọc tiếp
Đốt cháy hoàn toàn 7,2 gam hợp chất hữu cơ X thu được 11,2 lít CO2 (đktc) và 10,8 gam nước. Biết rằng 7,2 gam X có số mol bằng số mol của 3,2 gam khí oxi.
a) Xác định công thức phân tử của X.
b) Viết tất cả các công thức cấu tạo có thể có của X.
\(n_C=n_{CO_2}=0,5\left(mol\right);n_H=2.n_{H_2O}=2.\dfrac{10,8}{18}=1,2\left(mol\right)\\ m_C+m_H=0,5.12+1,2.1=7,7,2\\ \Rightarrow X.ko.có.oxi\left(O\right)\\ \Rightarrow CTTQ:C_xH_y\left(x,y:nguyên,dương\right)\\ x:y=n_C:n_H=0,5:1,2=5:12\\a, \Rightarrow x=5;y=12\Rightarrow CTPT.X:C_5H_{12}\\ b,CH_3-CH_2-CH_2-CH_2-CH_3\\ CH_3-CH\left(CH_3\right)-CH_2-CH_3\\ CH_3-C\left(CH_3\right)_2-CH_3\)
Đúng 0
Bình luận (0)
Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít
C
O
2
(đktc) và 2,25 g
H
2
O
. Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít
H
2
(đktc).1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.2. Tính giá trị m.
Đọc tiếp
Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít C O 2 (đktc) và 2,25 g H 2 O . Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít H 2 (đktc).
1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
2. Tính giá trị m.
1. Số mol
C
O
2
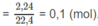
Số mol
H
2
O
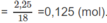
Khi đốt ancol A, số mol H 2 O tạo thành < số mol C O 2 . Vậy A phải là ancol no, mạch hở. A có dạng C n H 2 n + 2 - x ( O H ) x hay C n H 2 n + 2 O x .
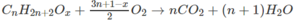
Theo đầu bài ta có:
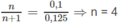
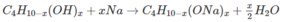
Theo phương trình : Cứ (58 + 16x) g A tạo ra 0,5000x mol H 2 .
Theo đầu bài:
Cứ 18,55 g A tạo ra 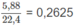 mol
H
2
.
mol
H
2
.
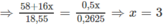
CTPT của A là C 4 H 10 O 3 .
Theo đầu bài A có mạch cacbon không nhánh; như vậy các CTCT thích hợp là
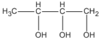 (butan-1,2,3 triol)
(butan-1,2,3 triol)
Và 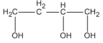 (butan-1,2,4-triol)
(butan-1,2,4-triol)
2. Để tạo ra 0,1 mol C O 2 ;
Số mol A cần đốt là: 
Như vậy: m = 0,025 x 106 = 2,65 (g).
Đúng 0
Bình luận (0)
Hai chất hữu cơ A và B có cùng công thức phân tử. Khi đốt cháy 2,9 gam A thu được 8,8 gam CO2 và 4,5 gam H2O. Ở đktc 2,24 lít khí B có khối lượng 5,8 gam. Hãy xác định công thức phân tử của A, B và viết công thức cấu tạo của mỗi chất
Ta có: \(M_A=M_B=\dfrac{5,8}{\dfrac{2,24}{22,4}}=58\left(g/mol\right)\)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{4,5}{18}=0,25\left(mol\right)\Rightarrow n_H=0,25.2=0,5\left(mol\right)\)
⇒ mC + mH = 0,2.12 + 0,5.1 = 2,9 (g)
→ A, B chỉ chứa C và H.
Gọi CTPT của A và B là CxHy.
⇒ x:y = 0,2:0,5 = 2:5
→ CTPT của A có dạng (C2H5)n
Mà: MA = MB = 58 (g/mol)
\(\Rightarrow n=\dfrac{58}{12.2+1.5}=2\)
Vậy: CTPT của A và B là C4H10.
CTCT của từng chất: \(CH_3-CH_2-CH_2-CH_3\) và \(CH_3-CH\left(CH_3\right)-CH_3\)
Đúng 1
Bình luận (0)
Đốt cháy 2,2 g hợp chất hữu cơ A thu được 3,6 g H2O và 3,36 lít khí CO2( đktc)
xác định công thức phân tử của A biết MA = 44 gam/mol
\(n_{H_2O}=\dfrac{3,6}{18}=0,2mol\)
\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{2,2}{44}=0,05mol\)
Số nguyên tử C:
\(\overline{C}=\dfrac{n_{CO_2}}{n_A}=\dfrac{0,15}{0,05}=3\)
Số nguyên tử H:
\(\overline{H}=\dfrac{2n_{H_2O}}{n_A}=\dfrac{2\cdot0,2}{0,05}=8\)
Vậy CTHH là \(C_3H_8\)
Đúng 5
Bình luận (0)
nH2O=3,618=0,2(mol)
Bảo toán C: nC(A) = 0,15 (mol)
Bảo toàn H: nH(A) = 0,2.2 = 0,4 (mol)
=>
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn một hidrocacbon A thì thu được 4,4 gam khi cacbon dioxit và 2,7 gam nước. Biết khối lượng mol của A là 30 gam. Hãy xác định công thức phân tử của A.
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\); \(n_{H_2o}=\dfrac{2,7}{18}=0,15\left(mol\right)\)
Bảo toàn C: nC(A) = 0,1 (mol)
Bảo toàn H: nH(A) = 0,3 (mol)
Xét nC : nH = 0,1 : 0,3 = 1 : 3
=> A có dạng (CH3)n
Mà MA = 30 (g/mol)
=> n = 2
=> A là C2H6
Đúng 2
Bình luận (0)






















