cho 6,45 ga hỗn hợp 2 kim loại A,B (đều có hóa trị II) tác dụng với dung dịch HCL dư được 1,12 lít H2 (đktc) và 3,2 gam chất rắn .lượng chất rắn này tác dụng vừa đủ với 200ml dung dịch AgNO3 0,1 M .A,B LÀ

Những câu hỏi liên quan
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, th...
Đọc tiếp
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
A. Al.
B. Na
C. Ca.
D. K.
Cho 10.8 gam hỗn hợp A gồm Cu và kim loại M (khối lượng của M lớn hơn khối lượng của Cu) tác dụng với dung dịch HCl dư, thu dược 2,912 lít khí (đktc). Nếu cho hỗn hợp A này tác dụng hết với dung dịch H2SO4 đặc, đun nóng thì thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, đktc). Mặt khác, nếu cho 5,4 gam hỗn hợp A tác dụng với 160 ml AgNO3 1M thu được m gam chắt rắn. Biết các phản ứng xảy ra hoàn toàn, kim loại M không có hóa trị (I) trong các hợp chất. Xác định giá trị m
Đọc tiếp
Cho 10.8 gam hỗn hợp A gồm Cu và kim loại M (khối lượng của M lớn hơn khối lượng của Cu) tác dụng với dung dịch HCl dư, thu dược 2,912 lít khí (đktc). Nếu cho hỗn hợp A này tác dụng hết với dung dịch H2SO4 đặc, đun nóng thì thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, đktc). Mặt khác, nếu cho 5,4 gam hỗn hợp A tác dụng với 160 ml AgNO3 1M thu được m gam chắt rắn. Biết các phản ứng xảy ra hoàn toàn, kim loại M không có hóa trị (I) trong các hợp chất. Xác định giá trị m
nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g
Đúng 1
Bình luận (0)
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy r...
Đọc tiếp
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy ra hoàn toàn.
Xác định kim loại M và tính thành phần phần trăm theo khối lượng của các chất có trong hỗn hợp X.
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa nung đến đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn....
Đọc tiếp
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa nung đến đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây ?
A. 75
B. 79
C. 73
D. 77
Đáp án A
Sơ đồ:
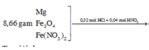
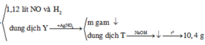
Ta giải được: ![]()
Do có sinh ra khí H2 nên dung dịch Y coi như đã hết NO 3 - .
Gọi a, b, c lần lượt là số mol 3 chất trong X
![]()
T tác dụng với NaOH lọc kết tủa rồi nung thu được 10,4 gam rắn gồm MgO và Fe2O3.
![]()
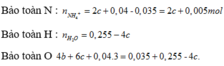
Giải hệ :a=0,2 ;b=0,005; c=0,015.
Kết tủa khi cho AgNO3 vào gồm AgCl 0,52 mol và Ag
Bảo toàn e:
![]()
→ m = 75,16 gam
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa nung đến đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn....
Đọc tiếp
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa nung đến đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
A. 75
B. 77
C. 79.
D. 73
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa nung đến đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn....
Đọc tiếp
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa nung đến đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây ?
A. 75
B. 79
C. 73
D. 77.
Đáp án A
Sơ đồ:
8 , 66 g a m M g F e 3 O 4 F e ( N O 3 ) 2 → 0 , 52 m o l H C l + 0 , 04 m o l H N O 3 1 , 12 l i t N O v à H 2 d u n g d ị c h Y → + A g N O 3 m g a m ↓ d u n g d ị c h T → N a O H ↓ → t 0 10 , 4 g a m
Ta giải được:
![]()
Do có sinh ra khí H2 nên dung dịch Y coi như đã hết N O - 3 .
Gọi a, b, c lần lượt là số mol 3 chất trong X
=> 24a + 232b + 180c = 8,66
T tác dụng với NaOH lọc kết tủa rồi nung thu được 10,4 gam rắn gồm MgO và Fe2O3.
=> 40a + 240b + 80c = 10,4
Bảo toàn N :
n N H + 4 = 2c + 0,04 - 0,035 = 2c + 0,005 mol
Bảo toàn H : n H 2 O = 0 , 255 - 4 c
Bảo toàn O 4b + 6c + 0,04.3 = 0,035 + 0,255 - 4c
Giải hệ :a=0,2 ;b=0,005; c=0,015.
Kết tủa khi cho AgNO3 vào gồm AgCl 0,52 mol và Ag
Bảo toàn e:
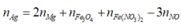
![]()
=> m = 75,16 gam
Đúng 0
Bình luận (0)
Cho 8,3g hỗn hợp kim loại Fe và Al tác dụng với dung dịch HCL dư thu được dung dịch X và 5,6 lít H2(đktc) Cho dung dịch X tác dụng với lượng dư NaOH thu được m gam kết tủa.Nung kết tủa trong không khí đến khối lượng không đổi thu được a gam chất rắn.Viết PTPƯ và tính m,a
Các PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
\(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
Kết tủa thu được gồm Fe(OH)2 và Al(OH)3
Đặt : \(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(\Rightarrow56a+27b=8,3g\left(1\right)\)
\(Bte:2n_{Fe}+3n_{Al}=2n_{H2}=2a+3b=2.\dfrac{5,6}{22,4}=\left(2\right)\)
Từ(1),(2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1=n_{Fe\left(OH\right)2}\\b=0,1=n_{Al\left(OH\right)3}\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)2}+m_{Al\left(OH\right)3}=0,1.90+0,1.78=16,8\left(g\right)\)
\(Bt\left(Al\right):n_{Al}=n_{Al2O3}=0,1\left(mol\right)\)
\(Bt\left(Fe\right):n_{Fe}=n_{Fe2O3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Chất.rắn}=0,1.160+0,1.102=26,2\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Đầu tiên, chúng ta sẽ viết các phương trình phản ứng cho mỗi bước của quá trình.
Bước 1: Phản ứng giữa hỗn hợp Fe và Al với dung dịch HCl: HCl (dung dịch) + Fe (kim loại) → FeCl2 (dung dịch) + H2 (khí)
2HCl + Fe → FeCl2 + H2
Bước 2: Phản ứng giữi dung dịch X với NaOH tạo kết tủa: X (dung dịch) + 2NaOH → 2NaX (dung dịch) + H2O (lỏng) + Al(OH)3 (kết tủa)
Bước 3: Nung kết tủa Al(OH)3 trong không khí: 2Al(OH)3 → Al2O3 + 3H2O
Bây giờ, chúng ta sẽ tính toán m và a.
Bước 1: Tính lượng H2 thoát ra.
Trước hết, chúng ta cần biết lượng mol của Fe trong hỗn hợp. Công thức của FeCl2 là Fe2+ (một cation sẽ tạo ra 1 mol H2 khi phản ứng với HCl). Vì vậy, số mol của Fe là bằng số mol H2.
Khối lượng mol của H2 là 2 g/mol, vì vậy số mol H2:
n(H2) = 5.6 l / 22.4 l/mol (ở điều kiện tiêu chuẩn) = 0.25 mol
Do đó, số mol Fe = 0.25 mol.
Khối lượng mol của Fe là 55.85 g/mol, vậy khối lượng của Fe là:
m(Fe) = 0.25 mol × 55.85 g/mol = 13.96 g
Bước 2: Tính lượng kết tủa Al(OH)3.
Al(OH)3 có khối lượng mol là 78 g/mol, và theo phương trình phản ứng ta thấy rằng mỗi mol Al(OH)3 tạo ra một mol kết tủa. Vì vậy, số mol Al(OH)3 tạo ra là bằng số mol NaOH đã sử dụng.
Số mol NaOH đã sử dụng được tính theo số mol H2O được tạo ra khi NaOH phản ứng. Một mol NaOH phản ứng với một mol H2O.
n(Al(OH)3) = n(NaOH) = n(H2O) = 0.25 mol
Khối lượng của Al(OH)3:
m(Al(OH)3) = 0.25 mol × 78 g/mol = 19.5 g
Bước 3: Nung kết tủa Al2O3 trong không khí.
Khối lượng của Al2O3 không thay đổi sau quá trình nung. Vì vậy, a = 19.5 g (cùng với m(Al(OH)3)).
Tóm lại:
m = 19.5 g (kết tủa Al(OH)3)a = 19.5 g (sau khi nung thành Al2O3)
Đúng 0
Bình luận (0)
Câu 1 Cho 4,8 gam kim loại M tác dụng với 0,1 mol Cl2 thu được hỗn hợp chất rắn X. Cho X vào dung dịch HCl dư thu được 2,24 lít H2 (đktc) và dung dịch Y. Tính khối lượng muối trong Y và xác định tên kim loại M.Câu 2 Cho hỗn hợp m gam Fe và Cu gam Fe vào dung dịch H2SO4 loãng (dư), thu được 5,6 lít khí H2 (đktc). Cũng cho hỗn hợp trên vào dung dịch H2SO4 đặc, nóng (dư) thu đươc 11,2 lít SO2 (sản phẩm khử duy nhất, đktc). Tính m.
Đọc tiếp
Câu 1 Cho 4,8 gam kim loại M tác dụng với 0,1 mol Cl2 thu được hỗn hợp chất rắn X. Cho X vào dung dịch HCl dư thu được 2,24 lít H2 (đktc) và dung dịch Y. Tính khối lượng muối trong Y và xác định tên kim loại M.
Câu 2 Cho hỗn hợp m gam Fe và Cu gam Fe vào dung dịch H2SO4 loãng (dư), thu được 5,6 lít khí H2 (đktc). Cũng cho hỗn hợp trên vào dung dịch H2SO4 đặc, nóng (dư) thu đươc 11,2 lít SO2 (sản phẩm khử duy nhất, đktc). Tính m.
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng vừa đủ dung dịch NaOH, lọc kết tủa nung đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn....
Đọc tiếp
Hòa tan hoàn toàn 8,66 gam hỗn hợp X gồm Mg, Fe3O4 và Fe(NO3)2 bằng dung dịch chứa hỗn hợp gồm 0,52 mol HCl và 0,04 mol HNO3 (vừa đủ), thu được dung dịch Y và 1,12 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối hơi đối với H2 là 10,8. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch T. Cho dung dịch T tác dụng với một lượng vừa đủ dung dịch NaOH, lọc kết tủa nung đến khối lượng không đổi thu được 10,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
A. 73.
B. 79.
C. 77.
D. 75.




















