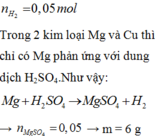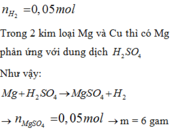Hòa Tan Hoàn Toàn 21,4 (gam) h2 Mg(OH)2 và Ca(OH)2 bằng 200g dd H2SO x% vừa đủ , sau Phản ứng thu được 40 (g) muối
a) Tìm x
b) Tìm C% Mỗi muối \(\odot\) sau phản ứng

Những câu hỏi liên quan
Hòa Tan Hoàn Toàn 21,4 (gam) h2 Mg(OH)2 và Ca(OH)2 bằng 200g dd H2SO x% vừa đủ , sau Phản ứng thu được 40 (g) muối
a) Tìm x
b) Tìm C% Mỗi muối trong đ sau phản ứng
Hòa Tan Hoàn Toàn 21,4 (gam) h2 Mg(OH)2 và Ca(OH)2 bằng 200g dd H2SO x% vừa đủ , sau Phản ứng thu được 40 (g) muối
a) Tìm x
b) Tìm C% Mỗi muối trong phản ứng
a)
Gọi n_{Mg(OH)_2} = a(mol) ; n_{Ca(OH)_2} = b(mol)$
\(Mg\left(OH\right)_2+H_2SO_4\text{→}MgSO_4+H_2O\)
a a a (mol)
\(Ca\left(OH\right)_2+H_2SO_4\text{→}CaSO_4+H_2O\)
b b b (mol)
Ta có :
$58a + 74b = 21,4$
$120a + 136b = 40$
Suy ra a = 0,05 ; b = 0,25
$n_{H_2SO_4} = a + b = 0,3(mol)$
$x\% = \dfrac{0,3.98}{200}.100\% = 14,7\%$
c)
$m_{dd} = 21,4 + 200 - 0,25.136 = 187,4(gam)$
$C\%_{MgSO_4} = \dfrac{0,05.120}{187,4}.100\% = 3,2\%$
Đúng 3
Bình luận (0)
Hòa Tan Hoàn Toàn 21,4 (gam) h2 Mg(OH)2 và Cu(OH)2 bằng 200g dd H2SO x% vừa đủ , sau Phản ứng thu được 40 (g) muối
a) Tìm x
b) Tìm C% Mỗi muối trong phản ứng
Giúp em với ạ :<
Bài 1 Hoà tan hoàn toàn m gam Mg cần vừa đủ 200( gam) dung dịch HCL 7,3%, sau phản ứng thu được V lít khí H2 (Đktc) a, Tìm m, V b, Gọi tên muối và tính khối lượng muối thu được c, Tính khối lượng H2 thu được sau phản ứng
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.200}{100}=14,6\left(g\right)\)
Số mol của axit clohidric
nHCl= \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
Pt : Mg + 2HCl → MgCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) Số mol của magie
nMg= \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của magie
mMg = nMg . MMg
= 0,2 . 24
= 4,8 (g)
Số mol của khí hidro
nH2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Thể tích của khí hidro
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
b) Tên của muối là : magie clorua
Số mol của muối magie clorua
nMgCl2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của muối magie clorua
mMgCl2 = nMgCl2 . MMgCl2
= 0,2 . 95
= 19 (g)
c) Khối lượng của khí hidro
mH2 = nH2 . MH2
= 0,2 . 2
= 0,4 (g)
Chúc bạn học tốt
Đúng 4
Bình luận (1)
mHCl=14,6(g) -> nHCl=0,4(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
a) Ta có: nH2=nMgCl2=nMg=1/2. nHCl=1/2. 0,4=0,2(mol)
m=mMg=0,2.24=4,8(g)
b) mMgCl2=0,2.95=19(g)
c) mH2=0,2.2=0,4(g)
Đúng 1
Bình luận (1)
1. Hòa tan hoàn toàn 5,4g nhôm cần vừa đủ V(l) dung dịch H2SO4 0,2M sau phản ứng thu được dung dịch B và X (lit) H2(đktc).
a) TÌm V?
b) Tìm X?
c) Tính CM của muối thu được trong dung dịch B?
2. Để hòa tan hoàn toàn m(g) kẽm cần vừa đủ 100(g) dung dịch H2SO4 4,9% .
a) Tìm m?
b) Tìm V lít khí thoát ra ở đktc?
c) Tính C% của muối thu được sau sau phản ứng?
Bài 1 :
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt : 2Al + 3H2SO4 → Al2(SO4)3 + 3H2\(|\)
2 3 1 3
0,2 0,3 0,3
a) Số mol của dung dịch axit sunfuric
nH2SO4 = \(\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
Thể tích của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,3}{0,2}=1,5\left(l\right)\)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,3.3}{3}=0,3\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,3. 22,4
= 6,72 (l)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
2. Để hòa tan hoàn toàn m(g) kẽm cần vừa đủ 100(g) dung dịch H2SO4 4,9% .
a) Tìm m?
b) Tìm V lít khí thoát ra ở đktc?
c) Tính C% của muối thu được sau sau phản ứng?
---
a) mH2SO4=4,9%.100=4,9(g) -> nH2SO4=4,9/98=0,05(mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
Ta có: nZn=nZnSO4=nH2=nH2SO4=0,05(mol)
m=mZn=0,05.65=3,25(g)
b) V(H2,đktc)=0,05.22,4=1,12(l)
c) mZnSO4=0,05. 161=8,05(g)
mddZnSO4=mZn + mddH2SO4 - mH2= 3,25+100 - 0,05.2=103,15(g)
=> C%ddZnSO4= (8,05/103,15).100=7,804%
Đúng 1
Bình luận (0)
Bài 2 :
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{4,9.100}{100}=4,9\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{4,9}{98}=0,05\left(mol\right)\)
Pt : Zn + H2SO4 → ZnSO4 + H2\(|\)
1 1 1 1
0,05 0,05 0,05 0,05
a) Số mol của kẽm
nZn = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của kẽm
mZn = nZn . MZn
= 0,05 . 65
= 3,25 (g)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,05 . 22,4
= 1,12 (l)
c) Số mol của muối kẽm clorua
nZnCl2 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối kẽm sunfat
mZnSO4 = nZnSO4 . MZnSO4
= 0,05 . 161
= 8,05 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mZn + mH2SO4 - mH2
= 3,25 + 100 - (0,05 . 2)
= 103,15 (g)
Nồng độ phàn trăm của muối kẽm sunfat
C0/0ZnSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{8,05.100}{103,15}=7,8\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Cu vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,12 lít H2 (đktc). Khối lượng muối thu được sau phản ứng là
A. 7,23 gam.
B. 5,83 gam.
C. 7,33 gam.
D. 6,00 gam.
Đáp án D
n H 2 = 0 , 05 m o l
Trong 2 kim loại Mg và Cu thì chỉ có Mg phản ứng với dung dịch H2SO4
Như vậy: ![]()
![]()
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Cu vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,12 lít H2 (đktc). Khối lượng muối thu được sau phản ứng là A. 7,23 gam B. 5,83 gam C. 7,33 gam D. 6,00 gam
Đọc tiếp
Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Cu vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,12 lít H2 (đktc). Khối lượng muối thu được sau phản ứng là
A. 7,23 gam
B. 5,83 gam
C. 7,33 gam
D. 6,00 gam
Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Cu vào một lượng vừa đủ dung dịch
H
2
loãng, sau phản ứng thu được 1,12 lít
H
2
S
O
4
(đktc). Khối lượng muối thu được sau phản ứng là A. 5,83 gam. B. 7,23 gam. C. 7,33 gam. D. 6,00 gam.
Đọc tiếp
Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Cu vào một lượng vừa đủ dung dịch H 2 loãng, sau phản ứng thu được 1,12 lít H 2 S O 4 (đktc). Khối lượng muối thu được sau phản ứng là
A. 5,83 gam.
B. 7,23 gam.
C. 7,33 gam.
D. 6,00 gam.
Câu 1: Hòa tan hoàn toàn 3,645 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,68 lít H2 (đktc) và dung dịch X. Tính khối lượng muối trong dung dịch X ( 3 cách) ?
Bài 2: Hoà tan hoàn toàn m gam hỗn hợp A gồm Mg, Al bằng dung dịch HCl sau phản ứng thu được dung dịch Y và 5,6 lit H2 (đktc). Cô cạn dung dịch Y thu được 22,85gam muối khan.
a. Tính mHCl đã tham gia phản ứng?
b. Tính khối lượng hỗn hợp A?
Đọc tiếp
Câu 1: Hòa tan hoàn toàn 3,645 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,68 lít H2 (đktc) và dung dịch X. Tính khối lượng muối trong dung dịch X ( 3 cách) ? Bài 2: Hoà tan hoàn toàn m gam hỗn hợp A gồm Mg, Al bằng dung dịch HCl sau phản ứng thu được dung dịch Y và 5,6 lit H2 (đktc). Cô cạn dung dịch Y thu được 22,85gam muối khan. a. Tính mHCl đã tham gia phản ứng? b. Tính khối lượng hỗn hợp A?
Bài 2 :
a)
$Mg + 2HCl \to MgCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$n_{H_2} = \dfrac{5,6}{22,4} = 0,25(mol)$
$n_{HCl} = 2n_{H_2} = 0,5(mol)$
$m_{HCl} = 0,5.36,5 = 18,25(gam)$
b)
Bảo toàn khối lượng :
$m_A = 22,85 + 0,25.2 - 18,25 = 5,1(gam)$
Đúng 0
Bình luận (0)