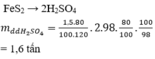Tính khối lượng axitsunfuric 96% thu được từ 60kg quặng Pirit sắt nếu hiệu suất quá trình là 85%

Những câu hỏi liên quan
từ 60kg quặng pirit,tính khối lượng H2SO4 thu được,hiệu suất quá trình phản ứng là 85%
tính khối lượng dd H2SO4 96% thu được.
a) Điều chế H2SO4 từ FeS2 qua các dãy biến hóa sau:
FeS2 -> 2SO2 -> 2SO3 -> 2H2SO4
120kg....................................2x98 kg
60kg.....................................98kg
Theo lý thuyết khối lượng H2SO4 sinh ra là 98 kg, nhưng hiệu suất 85% nên thực tế chỉ thu đc:
(98 x 85 ) : 100 = 83,3 kg
Khối lượng dd H2SO4 96% thu đc là:
100 kg dd có 96 kg H2SO4
Đúng 3
Bình luận (0)
1.Cho 1,12 lít khí \(SO_2\)(đktc) lội dd \(Ca\left(OH\right)_2\) dư thu được một kết tủa. Tính khối lượng kết tủa này biết hiệu suất phản ứng là 80%?
2. Tính khối lượng axitsunfuric 96% thu được từ 60kg quặng Pirit sắt nếu hiệu suất quá trình là 85%
1) PTHH :
SO2 + Ca(OH)2 - > CaSO3 + H2O
Theo đề ta có ; nSO2 = 1,12/22,4 = 0,05 (mol)
Vì do hiệu suất pư là 80% nên => nSO2=0,04(mol)
=> nCaSO3=0,04(mol)
=> mCaSO3=4,8(mol)
Đúng 0
Bình luận (0)
tìm câu hỏi tương tự trc khi đăng chứ , bạn đăng nhiều quá làm nản lắm
tim-kiem
Đúng 0
Bình luận (0)
1. Cho 1,12 lít khí SO2 (đktc) lội qua dung dịch Ca(OH)2 dư thu được một kết tủa. Tính khối lượng kết tủa này biết hiệu suất phản ứng là 80%?
2. Tính khối lượng axit sunfuric 96% thu được từ 60Kg quặng Pirit sắt nếu hiệu suất quá trình là 85%?
1.do hiệu suất nên nSO2=0,04(mol)
nCaSO3=0,04(mol)
\(\Rightarrow\) mCaSO3=4,8(mol)
Đúng 0
Bình luận (0)
Từ 45kg quặng pirit sắt có chứa 20% tạp chất dùng để điều chế H2SO4 70% với hiệu suất của toàn bộ quá trình là 60%. Tính khối lượng H2SO4 70% thu được.
\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)
Đúng 1
Bình luận (0)
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch
H
2
S
O
4
98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80%
F
e
S
2
(hiệu suất toàn quá trình là 80%) là A. 0,80 tấn B. 1,60 tấn C. 1,25 tấn D. 2,00 tấn
Đọc tiếp
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch H 2 S O 4 98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% F e S 2 (hiệu suất toàn quá trình là 80%) là
A. 0,80 tấn
B. 1,60 tấn
C. 1,25 tấn
D. 2,00 tấn
Trong công nghiệp, axit sunfuric được điều chế từ quang pirit sắt. Khối lượng H2SO4 điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% FeS2 ( hiệu suất toàn quá trình là 80%) là:
A. 1,568 tấn
B. 1,96 tấn
C. 1,25 tấn
D. 2,00 tấn
Đáp án A.
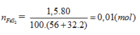
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
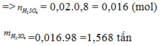
Đúng 0
Bình luận (0)
từ quặng pirit sắt sản xuất h2so4.
tính khối lượng quặng cần dùng để sản xuất 1 tấn h2so4 98%. biết hiệu suất của quá trình là 70%
\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)
Đúng 1
Bình luận (0)
a) Từ 60 kg quặng pirit sắt. Tính lượng H2SO4 96% thu đc từ quặng trên nếu hiệu suất là 85% so vs lý thuyết
b) Từ 80 tấn quặng pirit chứa 40% S sản xuất đc 92 tấn H2SO4.Hãy tính hiệu suất của quá trình
a) Điều chế H2SO4 từ FeS2 qua các dãy biến hóa sau:
FeS2 -> 2SO2 -> 2SO3 -> 2H2SO4
120kg....................................2x98 kg
60kg.....................................98kg
Theo lý thuyết khối lượng H2SO4 sinh ra là 98 kg, nhưng hiệu suất 85% nên thực tế chỉ thu đc:
(98 x 85 ) : 100 = 83,3 kg
Khối lượng dd H2SO4 96% thu đc là:
100 kg dd có 96 kg H2SO4
x kg dd có 83,3 kg
=> x = (83,3 . 100 ) : 96 = 86,77 kg
Đúng 0
Bình luận (1)
b) Lượng S trong 80 tấn quặng pirit
(40 . 80) : 100 = 32 tấn
Điều chế H2SO4 từ S qua dãy biến hóa sau:
S -> SO2 -> SO3 -> H2SO4
32 tấn.......................98 tấn
Nếu tính theo lý thuyết ta thu đc 98 tấn H2SO4
Vậy hiệu suất của quá trình là: (92 x 100) : 98 = 93,88 %
Đúng 0
Bình luận (0)
Bạn ơi cho mình hỏi là bạn lấy 85% ở đâu ạ
Đúng 0
Bình luận (0)
Tính khối lượng quặng pirit sắt có hàm lượng FeS2 là 75% dùng để sx 1 tấn H2SO4 98%. Biết hiệu suất cả quá trình sx là 80%?
\(m_{H_2SO_4}=10^6\cdot98\%=980000\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{980000}{98}=10000\left(mol\right)\)
Bảo toàn nguyên số S :
\(2n_{FeS_2}=n_{H_2SO_4}\Rightarrow n_{FeS_2}=\dfrac{10000}{2}=5000\left(mol\right)\)
\(\Rightarrow n_{FeS_2\left(tt\right)}=\dfrac{5000}{80\%}=6250\left(g\right)\)
\(m_{FeS_2}=6250\cdot120=750000\left(g\right)=0.75\left(tấn\right)\)
\(m_{quặng}=\dfrac{0.75}{75\%}=1\left(tấn\right)\)
Đúng 4
Bình luận (2)