Cho S tác dụng H2 thu H2S biết VH2S thu được là 1,68l. Hiệu suất pứ ;à 80%
a)Tính mS pứ
b)Tính VH2 pứ
Cho S tác dụng H2 thu H2S biết VH2S thu được là 1,68l. Hiệu suất pứ ;à 80%
a)Tính mS pứ
b)Tính VH2 pứ
Cho m g anilin tác dụng với dd HCl đặc dư, cô cạn dung dịch sau pứ thu được 15,54 g muối khan. Hiệu suất pứ đạt 80% . m có giá trị là :
A. 13,95g
B. 8,928g
C. 11,16g
D. 12,5g
Nếu phản ứng xảy ra hoàn toàn thì khối lượng hỗn hợp phải là 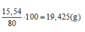
![]()
Cho 32 gam Fe2O3 tác dụng với 16,8 lít khí H2 thu được Fe ( hiệu suất phản ứng là 80%) cho tác dụng với HCl dư thì được V lít khí H2 dktc. Tìm V?
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,75}{3}\), ta được H2 dư.
Theo PT: \(n_{Fe\left(LT\right)}=2n_{Fe_2O_3}=0,4\left(mol\right)\)
Mà: H% = 80%
\(\Rightarrow n_{Fe\left(TT\right)}=0,4.80\%=0,32\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Fe}=0,32\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,32.22,4=7,168\left(l\right)\)
Bạn tham khảo nhé!
Cho lượng dư N2 tác dụng với 6,72 lít khí H2(đktc). Biết hiệu suất của phản ứng là 25%, thu được m(gam) NH3. Giá trị của m
$n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
$n_{H_2\ pư} = 0,3.25\% = 0,075(mol)$
\(N_2 + 3H_2 \buildrel{xt,t^,p}\over\rightleftharpoons 2NH_3\)
Theo PTHH :
$n_{NH_3} = \dfrac{2}{3}n_{H_2\ pư} = 0,05(mol)$
$m = 0,05.17 = 0,85(gam)$
Cho lượng dư N2 tác dụng với 10,08 lít khí H2(đktc). Biết hiệu suất của phản ứng là 37%, thu được V lít NH3(đktc). Giá trị của m
$n_{H_2} = \dfrac{10,08}{22,4} = 0,45(mol)$
$n_{H_2\ pư} = 0,45.37\% = 0,1665(mol)$
$N_2 + 3H_2 \buildrel{xt,t^,p}\over\rightleftharpoons 2NH_3$
$n_{NH_3} = \dfrac{3}{2}n_{H_2}= 0,111(mol)$
$V = 0,111.22,4 = 2,4864(lít)$
Cho 2,7g Al tác dụng với HCL dư thu được AlCl3 và giải phóng H2 . Tính khối lượng AlCl3 Tạo thành , biết hiệu suất phản ứng là 80%
2Al+6HCl----->2AlCl3+3H2
nAl=2,7/27=0,1 mol
cứ 2mol Al------> 2 mol AlCl3
0,1mol ----->0,1 mol
mAlCl3=0,1.133,5=13.35g
H%=80%------->mAlCl3 thực tế thu được =13,35.80/100=10,68g
n Al = 2,7/27 =0,1 mol
2Al + 6HCl ---> 2AlCl3 + 3H2
0,1 ---> 0,1
ADCT : H% =80% ----> m AlCl3 tạo thành = (m AlCl3 thực tế . H% ) / 100
hay m AlCl3 = ((0,1.133,5) .80 ) / 100 =10,68 %
Bài 10. Cho 6,72 lít H2 tác dụng với 4,48 lít Cl2 thu được hỗn hợp khí X. Cho hỗn hợp X tác dụng với dung dịch AgNO3 dư thu được 43,05 gam kết tủa trắng. Tính hiệu suất của phản ứng H2 tác dụng với Cl2?
\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)
Chia 7,8g hỗn hợp gồm C2H5OH và một ancol cùng dãy đồng đẳng thành 2 phần bằng nhau:
- Phần 1 cho tác dụng với Na dư thu được 1,12 lít H2 (đktc).
- Phần 2 cho tác dụng với 30 g CH3COOH, xúc tác H2SO4 (đ)
Biết hiệu suất các phản ứng este đều là 80%. Tổng khối lượng este thu được là:
A. 10,2 gam
B. 8,8 gam
C. 8,1 gam
D. 6,48 gam
Đáp án: D
Gọi công thức ancol cần tìm là: ROH
Số mol 2 ancol tương ứng là a, b
Phần 1:
→ a + b = 0,1
46a + (R+17)b = 3,9 → (29 – R)b = 0,7 → 29 > R → R = CH3 → CH3OH
Phần 2:
nCH3COOH = 0,5
H=80%
Nên ta có:
meste = 0,05.0,8(15+44+15+15+44+29) = 6,48
cho 11,2g sắt tác dụng vớI HCL thu đc FECL2 và khí H2. Biết hiệu suất là 75%. Tính khối lượng FECL2 và V khí H2.
Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{FeCl_2\left(LT\right)}=n_{H_2\left(LT\right)}=n_{Fe}=0,2\left(mol\right)\)
Mà: H% = 75%
\(\Rightarrow n_{FeCl_2\left(TT\right)}=n_{H_2\left(TT\right)}=0,2.75\%=0,15\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,15.127=19,05\left(g\right)\)
\(V_{H_2}=0,15.22,4=3,36\left(l\right)\)