Khí X có thành phần về khối lượng của các nguyên tố là 75% C và 25% H. Khí X có tỉ khối đối với không khí là 0,552.
a/ Tìm khối lượng mol của khí X.
b/ Tìm công thức hóa học của khí X.
Tìm công thức hóa học của hợp chất khí X có thành phần các nguyên tố là: 82,76%C; 17,24%H và tỉ khối đối với không khí là 2.
MX = 2.29 = 58 (g/mol)
\(m_C=\dfrac{82,76.58}{100}=48\left(g\right)=>n_C=\dfrac{48}{16}=4\left(mol\right)\)
\(m_H=\dfrac{17,24.58}{100}=10\left(g\right)=>n_H=\dfrac{10}{1}=10\left(mol\right)\)
=>CTHH: C4H10
\(M_X=29.2=58(g/mol)\)
Trong 1 mol X: \(n_C=\dfrac{58.82,76\%}{12}=4(mol);n_H=\dfrac{58.82,76}{1}=10(mol)\)
Vậy \(CTHH_X:C_4H_{10}\)
Câu 5:
1. Tìm khối lượng mol của khí X có tỉ khối đối với O2 là: 1,375; 0,0625.
2. Tìm khối lượng mol của khí X có tỉ khối đối với không khí là: 2,207; 1,172.
3. Tình công thức hóa học của khí X, biết khí X nặng hơn khí H2 17 lần.
4. Hãy tính thể tích khí O2 đủ để đốt cháy hết 11,2 lít khí X. a. Biết rằng tỉ khối của X đối với không khí là 0,552. b. Thành phần theo khối lượng của khí X là: 75% C và 25% H
1)
$M_X = 1,375.32 = 44(g/mol)$
$M_X = 0,0625.32 = 2(g/mol)$
2)
$M_X = 2,207.29 = 64(g/mol)$
$M_X = 1,172.29 = 34(g/mol)$
3)
$M_X = 17.2 = 34(g/mol)$
Vậy khí X là $H_2S$
4)
a) $M_X = 0,552.29 = 16$
Gọi CTHH của X là $C_xH_y$
Ta có : $\dfrac{12x}{75} = \dfrac{y}{25} = \dfrac{16}{100}$
Suy ra: x = 1 ; y = 4
Vậy X là $CH_4$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_ 2+ 2H_2O$
$V_{O_2} = 2V_{CH_4} = 11,2.2 = 22,4(lít)$
Câu 4:Một hợp chất khí X có tỉ khối đối với hidro là 8,5. Hãy xác định công thức hóa học của X biết hợp chất khí có thành phần theo khối lượng là 82,35% N và 17,65% H
Câu 5: Một hợp chất X của S và O có tỉ khối đối với không khí là 2,207.
a. Tính MX
b. Tìm công thức hóa học của hợp chất X biết nguyên tố S chiếm 50% khối lượng, còn lại là O.
câu 4
MX= 8,5.2 = 17
gọi công thức NxHy
=> x:y = \(\frac{82,35}{14}:\frac{17,65}{1}=1:3\)
=> NH3
câu 5
a.MX= 2,207.29 = 64
b. giả sử nX = 1 mol => mX = 64
gọi nS=x
ta có :32x = 64.50% => x = 1
mO = 64-32.1= 32 => nO = 32/16 = 2
=> nS:nO = 1:2 => SO2
Biết rằng khí A có tỉ khối đối với không khí là 0,552. Thành phần khí A gồm C và H. Tỉ lệ khối lượng của C và H trong khí A là 3:1.
Xác định công thức hoá học của A
\(\%C = \dfrac{3}{3 +1}.100\% = 75\%\\ \%H = \dfrac{1}{3 + 1}.100\% = 25\%\)
\(M_A = 0,522.29 = 16(đvC)\)
Số nguyên tử C = \(\dfrac{16.75\%}{12} = 1\)
Số nguyên tử H = \(\dfrac{16.25\%}{1} = 4\)
Vậy CTHH của A : \(CH_4\)
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A.
Biết rằng:
- Khí A có tỉ lệ khối đối với không khí là 0,552.
- Thành phần theo khối lượng của khí A là: 75% C và 25% H.
Các thể tích khí đo ở đktc.
dA/kk = 0,552 ⇒ Khối lượng mol của khí A: 29.0,552 = 16 (g)
Đặt CTHH của khí A là CxHy
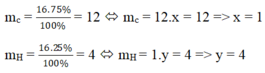
Công thức hóa học của khí A là: CH4
PTPỨ:

Tỉ lệ số mol cũng chính là tỉ lệ thể tích.
Theo phương trình nO2 = 2.nCH4 ⇒ VO2 = 2.VCH4 = 2.11,2 = 22,4(l)
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng: – Khí A có tỉ lệ khối đối với không khí là 0,552. Thành phần theo khối lượng của khí A là: 75% C và 25% H (Các thể tích khí đo ở đktc)
Ta có: \(M_A=0,552.29=16\)
Gọi CTTQ của A là \(C_xH_y\) (với x;y thuộc N*)
Ta có: \(x:y=\dfrac{\%m_C}{M_C}:\dfrac{\%m_H}{M_H}=\dfrac{75\%}{12}:\dfrac{25\%}{1}=0,0625:0,25=1:4\)
Suy ra CTDGN của A là \(\left(CH_4\right)_n\)
Mặt khác \(16.n=16\Rightarrow n=1\)
Vậy A là CH4
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=2.\dfrac{11,2}{22,4}=1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=22,4\left(l\right)\)
Một hợp chất X có thành phần khối lượng của các nguyên tố là \(85,714\%C,14,286\%H.\) Biết tỉ khối hơi của khí X đối với khí amoniac \(\left(NH_3\right)\) bằng \(1,647.\) Công thức hóa học của hợp chất X là
\(M_X=M_{NH_3}.1,647=17.1,647\approx 28(g/mol)\)
Trong 1 mol X: \(\begin{cases} n_C=\dfrac{28.85,714\%}{12}\approx 2(mol)\\ n_H=\dfrac{28-2.12}{1}=4(mol) \end{cases}\)
\(\Rightarrow CTHH_X:C_2H_4\)
MX=\(1,647.17=28\)g/mol
công thức dạng chung:CxHy
ta có:
x=85,714.28:100:12=2
y=14,286.28:100:1=4
Vậy CTHH là:C2H4
Câu 1: Một hợp chất khí X có tỉ khối đối với hidro là 8,5. Hãy xác định công thức hóa học của X biết hợp chất khí có thành phần theo khối lượng là 82,35&N và 17,65% H. (ĐS:NH3)
Câu 2: Một hợp chất X của S và O có tỉ khối đối với không khí là 2,207
a, Tính Mx (ĐS: 64 đvC)
b, Tìm công thức hóa học của hợp chất X biết nguyên tố S chiếm 50% khối lượng, còn lại là O. (ĐS: SO2)
Câu 1: Gọi CTHH của X là NxHy
Vì X có tỉ khối với hidro là 8,5
=> MX = 8,5 x 2 = 17 ( g / mol )
=> mN = 17 x 82,35% = 14 gam
=> nN =14 / 14 =1 mol
=> mH = 17 - 14 = 3 gam
=> nH = 3 / 1 = 3 mol
=> x : y = 1 : 3
=> CTHH của X : NH3
Câu 2:
a/ Vì X có tỉ khối đối với không khí là 2,207
=> MX = 2,207 x 29 = 64 ( g / mol)
b/ Gọi CTHH của X là SxOy
=> mS = 64 x 50% = 32 gam
=> nS = 32 / 32 = 1 mol
=> mO = 32 gam
=> nO = 32 / 16 = 2 mol
=> x : y = 1 : 2
=> CTHH của X : SO2
tính theo công thức hóa học
a) Tính % khối lượng của các nguyên tố trong hợp chất:NANO3,K2CO3,AL(OH)3;SO3;FE2O3
b) Một hợp chất khí X có tỉ khối đối với hidro là 8,5. Hãy xác định công thức hóa học của X biết hợp chất khí X có thành phần theo khối lượng là 82,35%N và 17,65%H.
Câu a) dễ bạn tự làm được đúng không mình làm mẫu một câu nha
Theo bài ra , ta có :
\(M_{NaNO_3}=23+\left(14+16\times3\right)=85\)(g/mol)
Trong 1 mol NaNO3 có 1 mol nt Na, 1mol nt N , 3 mol nt O
Thành phần % của các nguyên tử có trong hợp chất NaNO3 là :
\(\%Na=\left(\frac{1\times23}{85}\right)\times100\%\approx27\%\)
\(\%N=\left(\frac{1\times14}{85}\right)\times100\%\approx16,5\%\)
\(\%O=100\%-\left(\%Na+\%N\right)=100\%\left(27+16,5\right)=56,5\%\)
Vậy .....
b) Gọi CTDC là : NxHy
Theo bài ra , ta có :
dhợp chất X/H2= \(\frac{M_{N_xH_y}}{M_{H_2}}=8,5\Rightarrow M_{N_xH_y}=8,5\times M_{H_2}=8,5\times2=17\)(g/mol)
Khối lượng của nguyên tố trong hợp chất là :
\(m_N=\frac{MN_xH_y}{100\%}\times\%N=\frac{17\times82,35\%}{100\%}\approx14\left(g\right)\)
\(m_H=\frac{MN_xH_y}{100\%}\times\%H=\frac{17\times17,65\%}{100\%}\approx3\left(g\right)\)
Số mol của mỗi nt trong 1 mol Hợp chất NxHy là :
\(n_N=\frac{m}{M}=\frac{14}{14}=1\left(mol\right)\)
\(n_H=\frac{m}{M}=\frac{3}{1}=3\left(mol\right)\)
Suy ra trong 1 mol phân tử NxHy có : 1 nguyên tử N , 3 nguyên tử H
Vậy CTHH là : NH3
Chúc bạn học tốt =))![]()
MK2CO3=39*2+12+16*3=138(g/mol)
%K=39*2*100/138=56,52%
%C=12*100/138=8,70%
%O=100%-(56,52%+8,70%)=34,78%
MAl(OH)3=27+(16+1)*3=78(g/mol)
%Al=27*100/78=34,62%
%O=16*3*100/78=61,54%
%H=100%-(34,62%+61,54%)=3,84%
MSO3=32+16*3=80(g/mol)
%S=32*100/80=40%
%O=100%-40%=60%
MFe2O3=56*2+16*3=160(g/mol)
%Fe=56*2*100/160=70%
%O=100%-70%=30%
a) Hợp chất X có công thức : R2(SO4)3 . Biết phân tử khối của X là 342 Đvc . Tính nguyên tử cua R và cho biết R là nguyên tố nào ?
b) Hãy tìm công thức hoá học của A biết rằng :
- Tỉ khối của khí A đối với khí B là 2,125 và tỉ khối của khí B đối với khí oxi là 0,5
- Thành phần theo khối lượng của A là 5,88% H và 94,12 % S
a) Có 2R+(96x3)=342
Suy ra: R=27 là nhôm(Al)
b) MB=32x0,5=16
Suy ra: MA=16x2,125=34
Ta có : HuSv
5,88%=100u/34 =>u=2
94,12%=32 x 100 x v/34 => v=1
Vậy công thức hoá học của A là: H2S
Chúc bạn học tốt!