: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Hãy cho biết:a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 4,8 g lưu huỳnha) Khí sunfurơ nặng hay nhẹ hơn không khí bằng bao nhiêu lần?Câu 14: Cho 13gam Zn tác dụng với dung dịch H2SO4 thu được ZnSO4 và khí hidro Tính:a. Thể tích khí H2 thu được ở đktc.b. Khối lượng H2SO4 phản ứng.c. Khối lượng ZnSO4 tạo thành.Câ...
Đọc tiếp
: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 4,8 g lưu huỳnh
a) Khí sunfurơ nặng hay nhẹ hơn không khí bằng bao nhiêu lần?
Câu 14: Cho 13gam Zn tác dụng với dung dịch H2SO4 thu được ZnSO4 và khí hidro Tính:
a. Thể tích khí H2 thu được ở đktc.
b. Khối lượng H2SO4 phản ứng.
c. Khối lượng ZnSO4 tạo thành.
Câu 15: Cho một hợp chất sắt oxit có tỉ lệ khối lượng giữa sắt và oxi là:
mFe : mO = 7 : 3
a. Hãy xác định công thức phân tử của hợp chất oxit nói trên.
b. Tính số mol của 32g oxit nói trên.
ai chỉ mik vứ








 SO
SO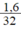 = 0,05 mol.
= 0,05 mol.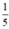 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là














