cho m gam sắt dư vào 20 ml dung dịch CuSo4 1M. sau khi phản ứng lọc được Adung dịch A và 4,08 g chất rắn B.
Tính m
Tính nồng độ mol của chất trong dung dịch A
cho 5,6g bột sắt vào 100ml dung dịch CuSO4 0,5M ( d = 1,08g/ml ) đến khi phản ứng kết thúc thu được chất rắn X và dung dịch Y lọc lấy chất rắn X đem hoà tan trong dung dịch HCl dư thấy còn lại m gam chất rắn k tan
a, Tính m
b, Tính nồng độ phần trăm châts tan trong dung dịch Y
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
.0,05...0,05............0,05.....0,05.....
Thấy : \(\dfrac{1.n_{Fe}}{1.n_{CuSO_4}}=\dfrac{0,1}{0,05}=2>1\)
=> Sau phản ứng thu được 0,05 mol FeSO4, 0,05 mol Fe dư, 0,05 mol Cu .
Thấy Cu không phản ứng với HCl .
\(\Rightarrow m=m_{Cu}=3,2\left(g\right)\)
b, \(m_{ddY}=5,6+108-3,2-2,8=107,6\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{0,05\left(56+96\right)}{107,6}.100\%\approx7,06\%\)
Cho 1,02 gam hỗn hợp A gồm Fe và Mg vào 200 ml dung dịch CuSO4. Sau khi các phản ứng hoàn toàn, lọc, thu được 1,38 gam chất rắn B và dung dịch C. Thêm dung dịch NaOH dư vào C, lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được 0,9 gam chất rắn D. Nồng độ mol/lít của dung dịch CuSO4 là:
A. 0,075M
B. 0,375M
C. 0,15M
D. 0,125M
Đáp án : A
Ta thấy chất rắn D gồm toàn oxit của Mg (và có thể của Fe) có m < mA
=> chứng tỏ A không phản ứng hết mà có kim loại dư.
Giả sử Fe chỉ phản ứng 1 phần với số mol là x; nMg = y
=> CuSO4 hết
=> moxit = mMgO + m F e 2 O 3 = 40y + 80x = 0,9g
Lại có : mB – mA = mCu – mMg – mFe pứ
=> 1,38 – 1,02 = 64.(x + y) – 24y – 56x
=> x = y = 0,0075 mol
=> n C u S O 4 = x + y = 0,015 mol
=> C M C u S O 4 = 0,075M
Cho 3,6 gam kim loại Mg vào 250 ml dung dịch FeCl3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn và dung dịch X. Tính m và nồng độ mol của các chất trong dung dịch X ( xem như thể tích dung dịch sau phản ứng không đổi) ?
nMg = 3,6/24 = 0,15 mol; nFeCl3 = 0,25.1 = 0,25 mol
Mg + 2FeCl3 → MgCl2 + 2FeCl2
0,125dư 0,025←0,25 → 0,125 → 0,25 (mol)
Mg + FeCl2 → MgCl2 + Fe
0,025→0,025 →0,025→0,025 (mol)
Vậy chất rắn sau phản ứng là Fe: nFe = 0,025 mol
=> m = mFe = 0,025.56 = 1,4 (gam)
Dung dịch X sau phản ứng gồm:
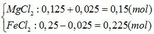
Nồng độ của các chất trong dung dịch X:
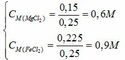
Cho 11,2 g fe vào 100 ml dung dịch A gồm CuSO4 có nồng độ x M và Fe2(SO4)3 1M sau phản ứng hoàn toàn thu được dung dịch x và 6,4 g chất rắn y .ngâm y trong dung dịch HCL dư không có khí thoát ra cho dung dịch NaOH đến dư vào dung dịch x lọc kết tủa nung trong không khí đến khối lượng không đổi thu được 40 gam chất rắn tính x
5. Ngâm bột sắt dư trong 10 ml dung dịch đồng sunfat 1M . Sau khi phản ứng kết thúc , lọc được chất rắn A và dung dịch B .
a) Cho A tác dụng với dung dịch HCL dư . Tính khối lượng chất rắn còn lại sau phản ứng .
b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B
giải nhanh giúp mk vớiiiiii ạ
\(n_{CuSO_4}=1.0,01=0,01(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\)
Do Cu ko td với HCl nên chất rắn sau phản ứng vẫn là Cu
\(n_{Cu}=n_{Fe}=0,01(mol)\\ \Rightarrow m_{Cu}=0,01.64=0,64(g)\\ b,PTHH:FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{NaOH}=2n_{FeSO_4}=2n_{Fe}=0,02(mol)\\ \Rightarrow V_{dd_{NaOH}}=0,02.1=0,02(l)\)
a) Đổi 10ml = 0,01l
nCuSO4 = V. CM = 0,01 . 1 = 0,01 mol
PTHH : Fe + CuSO4 -> Fe SO4 + Cu
PT : 1 1 1 1
Đề: 0,01 0,01
mCu = n . M = 0,01 . 64 = 0,64 g
b) PTHH : FeSO4 + 2NaOH -> Fe(OH)2 + NaSO4
PT : 1 2 1 1
Đề: 0,01 0,02
VNaOH = \(\dfrac{n}{CM}\) = \(\dfrac{0,02}{1}\) = 0,02l = 20ml
Cho 2,4 g bột sắt vào 250 ml dung dịch CuCl2 0,2M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và chất rắn
a/ Viết phương trình hóa học
b/ Tính khối lượng chất rắn thu được sau phản ửng
c/ Xác định nồng độ mol của các chất tan trong dung dịch A. Giả thiết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể.
Cho 40 ml dung dịch có chứa 15,2 gam CuSO4 tác dụng vừa đủ với dung dịch NaOH 2M
a) Tính khối lượng chất rắn thu được sau phản ứng và thể tích dung dịch NaOH cần dùng.
b) tính nồng độ mol các chất tan có trong dung dịch sau phản ứng?
c) Lọc lấy kết tủa nung trong không khí đến khối lượng không đổi thu được bao nhiêu gam chất rắn
\(n_{CuSO_4}=\dfrac{15,2}{160}=0,095mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,095 0,19 0,095 0,095
\(m_{rắn}=m_{Cu\left(OH\right)_2}=0,095.98=9,31g\\ V_{ddNaOH}=\dfrac{0,19}{2}=0,095l\\ b)C_{M_{Na_2SO_4}}=\dfrac{0,095}{0,04+0,095}\approx0,7M\\ c)Cu\left(OH\right)_2\xrightarrow[t^0]{}CuO+H_2O\)
0,095 0,095
\(m_{rắn}=m_{CuO}=0,095.80=7,6g\)
Cho 8 gam bột Cu vào 20 ml dung dịch AgNO 3 , sau một thời gian thu được dung dịch A và lọc được 9,52 gam chất rắn. Cho tiếp 8 gam bột Pb vào dung dịch A đến khi phản ứng hoàn toàn thu được dung dịch B chỉ chứa một muối duy nhất và tách ra được 6,705 gam chất rắn. Nồng độ mol của AgNO3 ban đầu là
A. 2,0M
B. 2,5M
C. 3,5M
D. 1,0M
Ngâm 8,4g Fe trong dung dịch 100ml CuSO4 1M, cho đến khi phản ứng kết thúc thu được chất rắn A và dung dịch B. Hòa tan chất rắn A trong dung dịch HCl dư thoát ra V lít khí ở đktc
a) Tính V?
b)Tính nồng độ mol của dung dịch B.Biết rằng thể tích dung dịch thay đổi không đáng kể.
\(n_{CuSO_4}=0,1.1=0,1\left(mol\right)\)
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
Xét tỉ lệ \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) => CuSO4 hết, Fe dư
PTHH: Fe + CuSO4 --> FeSO4 + Cu
_____0,1<---0,1---------->0,1
Fe + 2HCl --> FeCl2 + H2
0,05------------------->0,05
=> VH2 = 0,05.22,4 = 1,12(l)
b) \(C_{M\left(FeSO_4\right)}=\dfrac{0,1}{0,1}=1M\)