Cho 300ml dung dịch Hcl 1M tác dụng với dung dịch có hòa tan 4 gam NaOH thu đượcv muối và nước
a)Hãy viết phương trình hóa học xảy ra.
b)Hãy cho biết chất nào còn dư và dư bao nhiêu gam ?
c)Xác định khối lượng muối thu được sau phản ứng .
Cho 3,65g axit HCL tác dụng với 200 ml dung dịch NaOH 1M a,viết phương trình hóa học xảy ra? b,chất nào còn dư? khối lượng là bao nhiêu?c,tính khối lượng muối tạo thành?
\(a,HCl+NaOH\rightarrow NaCl+H_2O\\ b,n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\\ n_{NaOH}=0,2.1=0,2mol\\ \Rightarrow\dfrac{0,1}{1}< \dfrac{0,2}{1}\Rightarrow NaOH.dư\\ n_{NaCl}=n_{NaOH,pư}=n_{HCl}=0,1mol\\ m_{NaOH,dư}=\left(0,2-0,1\right).40=4g\\ c,m_{NaCl}=0,1.58,5=5,85g\)
Trộn 200 gam dung dịch một muối sunfat của kim loại kiềm nồng độ 13,2% với 200 gam dung dịch NaHCO3 4,2% sau phản ứng thu được m gam dung dịch A (m < 400 gam). Cho 200 gam dung dịch BaCl2 20,8% vào dung dịch A sau phản ứng còn dư muối sunfat. Thêm tiếp 40 gam dung dịch BaCl2 20,8%, dung dịch thu được còn dư BaCl2. Biết các phản ứng xảy ra hoàn toàn.
a) Xác định công thức muối sunfat của kim loại kiềm ban đầu.
b) Tính nồng độ % của các chất tan trong dung dịch A.
c) Dung dịch muối sunfat của kim loại kiềm ban đầu có thể tác dụng được với các chất nào sau đây: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Ag, Fe, CuS, Fe(NO3)2? Viết phương trình hóa học của các phản ứng xảy ra.
a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
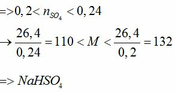
b)
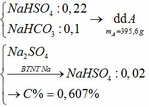
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O
Hỗn hợp X 1 gồm Fe , FeCO 3 và kim loại M (có hóa trị không đổi). Cho 23,7 gam X 1 tác dụng với 1 lít dung dịch HNO 3 1M, thu được dung dịch X 2 và 6,272 lít hỗn hợp Y 1 (có tỉ khối so với hiđro là 17,5) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO 3 dư có trong dung dịch X 2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X 3 . Chia X 3 làm hai phần bằng nhau:
- Phần 1: đem cô cạn thì thu được 42,45 gam hỗn hợp muối khan.
- Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 10,7 gam kết tủa của 1 chất.
Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
A. 1,2
B. 2
C. 1,5
D. 2,5
Hòa tan 14 gam hỗn hợp Cu, Fe3O4 vào dung dịch HCl, sau phản ứng còn dư 2,16 gam hỗn hợp chất rắn và dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư thì thu được bao nhiêu gam kết tủa? Biết các phản ứng xảy ra hoàn toàn.
A. 12,96.
B. 47,42.
C. 45,92.
D. 58,88.
m chất rắn phản ứng = 14 - 2,16 = 11,84
Trong 11,84g, gọi nFe3O4 = a;nCu = b
=> 232a + 64b = 11,84
Fe3O4+8HCl => 2FeCl3 + FeCl2 + 4H2O
a--------------2a------a
Cu + 2Fe(3+) => 2Fe(2+) + Cu(2+)
b------2a------------2a
Xét 11,84 g chất rắn thì sau p/u không còn chất rắn dư
=> Cu đã bị hào tan hết bởi Fe(3+)
=> b=2a/2=a
=> 232a + 64a = 11,84
=> a = 0,04
X có 3a = 0,12FeCl2; 0,04CuCl2
=> nCl(-) = 0,12*2 + 0,04*2 = 0,32
Ag(+)+Cl(-) => AgCl; Fe(2+)+Ag(+) => Fe(3+)+Ag
--------0,32----0,32; 0,12--------------------0,12
=> m(kết tủa) = 0,32*143,5 +0,12*108 = 58,88
=> Đáp án D
Hỗn hợp X1 gồm Fe, FeCO3 và kim loại M ( có hóa trị không đổi). Cho 14,1 gam X1 tác dụng với 500 ml dung dịch HNO3 xM, thu được dung dịch X2 và 4,48 lít hỗn hợp Y1 ( có tỉ khối so với hidro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO3 dư có trong dung dịch X2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X3. Chia X3 làm hai phần bằng nhau:
– Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan.
– Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 8,025 gam kết tủa của 1 chất.
Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
A. 2,26
B. 2,42
C. 2,31
D. 1,98
Đáp án C
* Hỗn hợp gồm kim loại M, Fe, FeCO3 tác dụng với dung dịch HNO3 thu được 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí nên 2 khí là NO và CO2
Tính được nCO2=0,05 mol, n(NO)=0,15 mol nên n(FeCO3)=n(CO2)=0,05 mol.
Đặt nM=a mol, nên n(Fe)=b mol. Ta có: aM+56b+116.0,05=14,1
Nên aM+56b=8,3 (1)
- Dung dịch X2 có : a mol M(NO3)n; (b+0,05) mol Fe(NO3)3, HNO3 dư, có thể có c mol NH4NO3.
+ Phản ứng trung hòa:
HNO3+NaOH→NaNO3+H2O
n(NaOH)= n (HNO3dư)=0,2.1=0,2 mol
- dung dịch X3 có a mol M(NO3)n,( b+0,05) mol Fe(NO3)3, 0,2 mol NaNO3, có thể c mol NH4NO3.
* Cô cạn ½ dung dịch X3, tổng khối lượng chất rắn thu được là:
(M+62n)a+242(b+0,05)+80.c+85.0,2=38,3.2=76,6
aM+62an+242b+80c=47,5 (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
Fe(NO3)3+3NaOH→3NaNO3+Fe(OH)3
Ta có: 107(b+0,05)=16,05 suy ra b=0,1
Theo bảo toàn electron, ta có: an+ 0,3+0,05=0,45+8c suy ra an=0,1+8c (5)
Từ (1) suy ra aM=2,7 (6)
Từ (2) aM+62an+80c=23,3 (7)
Từ (5), (6), (7) an=0,3; c=0,025 M=9n n=3; M=27 là Al là nghiệm thỏa mãn.
n(HNO3 phản ứng)=nN(sp)=0,1.3+0,15.3+0,025.2+0,15=0,95mol
n(HNO3 bắt đầu)=0,95+0,2=1,15 mol x= CM(HNO3)=2,3M.
Hỗn hợp X 1 gồm Fe , FeCO 3 và kim loại M (có hóa trị không đổi). Cho 14,1 gam X 1 tác dụng với 500 ml dung dịch HNO 3 xM, thu được dung dịch X 2 và 4,48 lít hỗn hợp Y 1 (có tỉ khối so với hiđro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO 3 dư có trong dung dịch X 2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X 3 . Chia X 3 làm hai phần bằng nhau: - Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan. - Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 8,025 gam kết tủa của 1 chất. Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
A. 2,26
B. 2,42
C. 2,31
D. 1,98
Cho X là hỗn hợp của 3 chất gồm kim loại M, oxit và muối sunfat của kim loại M. Biết M có hóa trị II không đổi trong các hợp chất. Chia 29,6 gam X thành hai phần bằng nhau:
– Phần 1: đem hòa tan tỏng dung dịch H2SO4loãng dư thu được dung dịch A, khí B. Lượng khí B này vừa đủ để khử hết 16 gam CuO. Sau đó cho dung dịch A tác dụng với dung dịch KOH dư, đến khi kết thúc phản ứng thu được kết tủa C. Nung C đến khối lượng không đổi thì thu được 14 gam chất rắn.
– Phần 2: cho tác dụng với 200 ml dung dịch CuSO4 1,5M. Sau khi kết thúc phản ứng tách bỏ chất rắn, cô cạn phần dung dịch thì thu được 46 gam muối khan.
a) Viết phương trình phản ứng xảy ra và xác định kim loại M.
b) Tính phần trăm khối lượng các chất trong X.

Bảo toàn nguyên tố M: nMSO4 = 0,25mol
Bảo toàn nguyên tố Cu: nCuSO4 dư = 0,1 mol
=> M = 24 (Mg)
b.

Cho 13g kẽm tác dụng với 200 gam dung dịch axit H2SO4 nồng độ 24,5%.
a. Viết phương trình phản ứng xảy ra?
b. Sau phản ứng chất nào còn dư và dư bao nhiêu gam?
c. Tính khối lượng muối tạo thành và khối lượng hiđro thoát ra?
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 < n_{H_2SO_4} = \dfrac{200.24,5\%}{98} = 0,5 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} =n_{Zn} = 0,2(mol)\\ \Rightarrow m_{H_2SO_4\ dư} = (0,5 - 0,2).98 = 29,4(gam)\\ c) n_{FeSO_4} = n_{H_2} = n_{Zn} = 0,2(mol)\\ m_{FeSO_4} = 0,2.152 = 30,4(gam)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\)
dẫn từ từ 1,568(l) khí CO2 (đktc) vào dung dịch có hòa tan 6,4g NaOH, sản phẩm ít muối Na2CO3 vào nước a. viết phương trình phản ứng
b. xác định khối lượng muối thu được
c. chất nào lấy dư và dư bao nhiêu gam
\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
0,07 0,14 0,07 0,07
\(nCO_2=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
\(nNaOH=\dfrac{6,4}{23+17}=0,16\left(mol\right)\)
LTL : \(\dfrac{0,07}{1}< \dfrac{0,16}{2}\)
=> NaOH dư , CO2 đủ
\(nNaOH_{\left(dư\right)}=0,16-0,14=0,02\left(mol\right)\)
\(mNaOH_{\left(dư\right)}=0,02.40=0,8\left(g\right)\)