Hãy giải thích vì sao năng lượng ion hoá thứ nhất của N: 1402 (KJ/mol) lớn hơn O: 1314 (KJ/mol).

Những câu hỏi liên quan
Biết năng lượng liên kết của phân tửCl2là 243 kJ mol-1, năng lượng ion hoá thứ nhất của nguyên tử Cl và phân tử Cl2 lần lượt là 1 250 và 1 085 kJ mol-1. Tính năng lượng liên kết của Cl2 + và thảo luận tiểu phân nào (Cl2, Cl2 +) có liên kết dài hơn. Giải thích.
Đọc tiếp
Biết năng lượng liên kết của phân tửCl2là 243 kJ mol-1, năng lượng ion hoá thứ nhất của nguyên tử Cl và phân tử Cl2 lần lượt là 1 250 và 1 085 kJ mol-1. Tính năng lượng liên kết của Cl2 + và thảo luận tiểu phân nào (Cl2, Cl2 +) có liên kết dài hơn. Giải thích.
Ta có hai sơ đồ ứng với quá trình:
\(Cl_2->2Cl->Cl^+,Cl\\ Cl_2->Cl_2^+->Cl^+,Cl\)
Theo nguyên lý I của nhiệt động học:
\(E_{b\left(Cl_2\right)}+IE_{Cl}=IE_{Cl_2}+E_{b\left(Cl_2^+\right)}\\ E_{b\left(Cl_2^+\right)}=243+1250-1085=408kJ\cdot mol^{-1}\\ E_{b\left(Cl_2^+\right)}>E_{b\left(Cl_2\right)}\)
Vì \(Cl_2^+\) có ít hơn một e phản liên kết so với Cl2, bậc liên kết cao hơn (1.5), do đó tiểu phân \(Cl_2\) có liên kết dài hơn.
Đúng 1
Bình luận (0)
Năng lượng liên kết của liên kết C – C (trong phân tử ethane) là 368 kJ mol-1 và năng lượng liên kết của liên kết C = C (trong phân tử ethene) là 636 kJ mol-1. Hãy cho biết liên kết nào (σ hay π) dễ bị bẻ gãy hơn khi phân tử tham gia phản ứng.
Liên kết đơn C – C có gồm 1 liên kết σ có năng lượng là 368 kJ mol-1.
Liên kết đôi C = C gồm 1 liên kết σ và liên kết π có năng lượng là 636 kJ mol-1.
=> Năng lượng của liên kết π là: 636 – 368 = 268 (kJ mol-1)
Vì năng lượng của liên kết σ (368 kJ mol-1) lớn hơn năng của liên kết π (268 kJ mol-1) nên khi phân tử tham gia phản ứng, liên kết π dễ bị bẻ gãy hơn.
Đúng 0
Bình luận (0)
a) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng:
N2(g) + O2(g) → 2NO(g)
b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
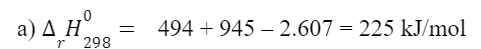
b) Trong N2, liên kết giữa 2 nguyên tử là liên kết ba – một loại liên kết bển, cần 1 năng lượng rất lớn để phá vỡ liên kết đó.
=> N2 khá trơ về mặt hóa học và chỉ phản ứng với oxy khi có nhiệt đô cao hoặc có tia lửa điện
Đúng 1
Bình luận (0)
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:4NH3(g) + 5O2(g) (Pt, t°) → 4NO(g) + 6H2O(g)a) Tính ΔrH^0_{298} của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol.b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N─H, O═O, O─H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
Đọc tiếp
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
4NH3(g) + 5O2(g) (Pt, t°) → 4NO(g) + 6H2O(g)
a) Tính Δ\(rH^0_{298}\) của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt lượng này để làm gì?
Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 90,3 kJ/mol và -241,8 kJ/mol.
b) Tính năng lượng liên kết trong phân tử NO. Biết năng lượng liên kết N─H, O═O, O─H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
Enthalpy tạo thành của H2O2 là -133 kJ mol-1, năng lượng liên kết OH là 463 kJ mol-1 và năng lượng phân ly H2, O2 lần lượt là 436 và 495 kJ mol-1. Tính năng lượng liên kết OO trong H2O2
Đọc tiếp
Enthalpy tạo thành của H2O2 là -133 kJ mol-1, năng lượng liên kết O![]() H là 463 kJ mol-1 và năng lượng phân ly H2, O2 lần lượt là 436 và 495 kJ mol-1. Tính năng lượng liên kết O
H là 463 kJ mol-1 và năng lượng phân ly H2, O2 lần lượt là 436 và 495 kJ mol-1. Tính năng lượng liên kết O![]() O trong H2O2
O trong H2O2
\(H_2+O_2->H_2O_2\\ \Delta_fH=E_{H-H}+E_{O=O}-2E_{H-O}-E_{O-O}\\ -133=436+495-2\cdot463-E_{O-O}\\ E_{O-O}=138kJ\cdot mol^{-1}\)
Đúng 1
Bình luận (0)
tính ∆h 298 của phản ứng sau: c2h2(k) + 2h2(k) = c2h6(k) cho biết năng lượng liên kết ở điều kiện chuẩn, 25oc. e (c-c) = 347.3 kj/mol e (c-h) = 412.9 kj/mol e (h-h) = 435.5 kj/mol e (c≡c) = 810.9 kj/mol
d) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945
kJ/mol và 607 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng dưới đây bằng bao nhiêu?
N2(g) + O2(g) 2NO(g)
A. -832 kJ. B. +832 kJ. C. -225 kJ. D. +225 kJ.
\(\Delta_rH^{^o}_{298}=945+494-2\cdot607=+225kJ\\ \Rightarrow D\)
Đúng 1
Bình luận (0)
Năng lượng liên kết là gì? Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết điều gì?
- Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí.
- Để phá vỡ 1 mol liên kết Cl – Cl thành các nguyên tử H và Cl ( ở thể khí) cần năng lượng là 243 kJ, nên năng lượng liên kết Cl – Cl là Eb = 243 kJ/mol
Đúng 1
Bình luận (0)
Hãy so sánh △H0298 của pư khử Fe2O3 bằng các chất khử khác nhau: H2 , C, CO. Qua đó cho biết để khử sắt oxit thì dùng chất nào tốt nhất. Biết:
△H0298 của các chất
Fe2O3 : -822,2 kJ/mol
H2O(hơi) : -241,8 kJ/mol
CO: -110,5 kJ/mol
CO2 : -393,5 kJ/mol













