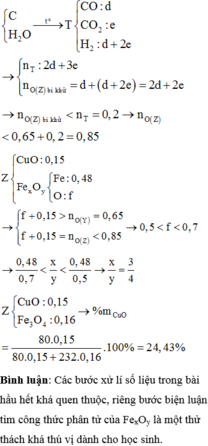cho 31,4g hỗn hợp gồm NaHSO3và Na2CO3vào 400g dung dịch H2SO4 9,8% đun nóng để phản ứng hoàn toàn thu đc hỗn hợp khí A có tỉ khối hơi so với H2 là 28,66 và dung dịch X . tính C% các chất trong X

Những câu hỏi liên quan
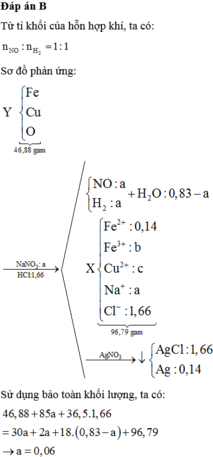
Cho hơi nước đi qua than nóng đỏ, thu được 4,48 lít (đktc) hỗn hợp khí T gồm CO, CO2 và H2. Dẫn toàn bộ T đi qua m gam hỗn hợp Z gồm FexOy và CuO nung nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được 46,88 gam hỗn hợp rắn Y. Cho Y tan hoàn toàn trong dung dịch chứa NaNO3 và 1,66 mol HCl, thu được dung dịch X chỉ chứa 96,79 gam muối của kim loại và hỗn hợp hai khí gồm NO và H2, có tỉ khối so với He là 4. Cho X phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 253,33 gam kết tủa. Phần trăm...
Đọc tiếp
Cho hơi nước đi qua than nóng đỏ, thu được 4,48 lít (đktc) hỗn hợp khí T gồm CO, CO2 và H2. Dẫn toàn bộ T đi qua m gam hỗn hợp Z gồm FexOy và CuO nung nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được 46,88 gam hỗn hợp rắn Y. Cho Y tan hoàn toàn trong dung dịch chứa NaNO3 và 1,66 mol HCl, thu được dung dịch X chỉ chứa 96,79 gam muối của kim loại và hỗn hợp hai khí gồm NO và H2, có tỉ khối so với He là 4. Cho X phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 253,33 gam kết tủa. Phần trăm khối lượng của CuO trong Z là
A. 25,77%
B. 24,43%
C. 23,81%
D. 25,60%
Hỗn hợp A gồm Al và S. Nung nóng 10,2g hỗn hợp A để phản ứng xảy ra hoàn toàn thu được hỗn hợp B. Hòa tan B trong dung dịch HCl dư thu được hỗn hợp khí C có tỉ khối so với H2 là 9a) Tính % thể tích các chất trong hỗn hợp Cb) Tính % khối lượng các chấ...
Xem chi tiết
PTHH: \(2Al+3S\underrightarrow{^{t^o}}Al_2S_3\)
Gọi số mol Al là x; S là y.
Ta có phương trình : \(27x+32y=10,2\left(g\right)\)
Vì cho Y tác dụng với HCl thu được hỗn hợp khí nên Al dư
\(\Rightarrow n_{Al_2S_3}=\dfrac{1}{3}n_S=\dfrac{y}{3}\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=x-\dfrac{2y}{3}\left(mol\right)\)
PTHH:
\(Al_2S_3+6HCl\rightarrow2AlCl_3+3H_2S\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{H2S}=3n_{Al2S3}=y\left(mol\right);n_{H2}=\dfrac{3}{2}n_{Al}=1,5x-y\left(mol\right)\)
\(M_Z=18\)
Áp dụng quy tắc đường chéo :
\(\Rightarrow\dfrac{n_{H2S}}{n_{H2}}=\dfrac{16}{16}\Rightarrow1,5x-y=y\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{10,2}=52,94\%\\\%m_S=100\%-52,94\%=47,06\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Ở nhiệt độ phòng, hỗn hợp khí X gồm hiđrocacbon A và lượng dư hiđro có tỉ khối so với H2 là 3,375. Khi cho X qua Ni đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y có tỉ khối so với H2 là 4,5. a) Xác định công thức phân tử của A. b) Tính thành phần phần trăm theo thể tích của các chất có trong X. Nếu cho X qua Pd/BaSO4 đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z. Trong Z chỉ có hai chất khí là B và hiđro. c) Viết phương trình phản ứng tạo thành B...
Đọc tiếp
Ở nhiệt độ phòng, hỗn hợp khí X gồm hiđrocacbon A và lượng dư hiđro có tỉ khối so với H2 là 3,375. Khi cho X qua Ni đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y có tỉ khối so với H2 là 4,5.
a) Xác định công thức phân tử của A.
b) Tính thành phần phần trăm theo thể tích của các chất có trong X.
Nếu cho X qua Pd/BaSO4 đun nóng cho đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z. Trong Z chỉ có hai chất khí là B và hiđro.
c) Viết phương trình phản ứng tạo thành B trên. Tính tỉ khối của Z so với hiđro.
d) B có thể cho phản ứng polime hóa. Viết phương trình phản ứng này.
Hợp chất B cho phản ứng với Cl2 ở 500 tạo thành C (có chứa 46,4% khối lượng Cl). C phản ứng với dung dịch NaOH loãng thu được D. Cho D phản ứng với nước và Cl2 thu được E (có chứa 32,1% khối lượng Cl). Sau cùng E phản ứng với dung dịch NaOH loãng thu được F.
e) Viết công thức cấu tạo của các chất từ B đến F và viết các phương trình hóa học xảy ra
a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
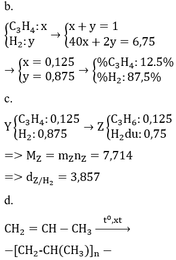

Đúng 0
Bình luận (0)
Hỗn hợp hai chất X (C5H16O4N2) và Y (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam hỗn hợp E gồm hai muối Z và T (MZ MT) và 4,48 lít (đktc) hỗn hợp M gồm hai amin đồng đẳng kế tiếp có tỉ khối hơi so với H2 bằng 18,3. Khối lượng của muối T trong E là A. 4,24 gam. B. 3,18gam. C. 5,36 gam. D. 8,04 gam.
Đọc tiếp
Hỗn hợp hai chất X (C5H16O4N2) và Y (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam hỗn hợp E gồm hai muối Z và T (MZ < MT) và 4,48 lít (đktc) hỗn hợp M gồm hai amin đồng đẳng kế tiếp có tỉ khối hơi so với H2 bằng 18,3. Khối lượng của muối T trong E là
A. 4,24 gam.
B. 3,18gam.
C. 5,36 gam.
D. 8,04 gam.
Đáp án D.
Khi cho hỗn hợp X tác dụng với NaOH vừa đủ thì:
![]()
![]()
![]()
![]()
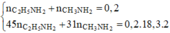
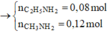

Đúng 0
Bình luận (0)
Hỗn hợp hai chất X (C5H16O4N2) và Y (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam hỗn hợp E gồm hai muối Z và T (MZ MT) và 4,48 lít (đktc) hỗn hợp M gồm hai amin đồng đẳng kế tiếp có tỉ khối hơi so với H2 bằng 18,3. Khối lượng của muối T trong E là A. 4,24 gam. B. 3,18gam. C. 5,36 gam. D. 8,04 gam.
Đọc tiếp
Hỗn hợp hai chất X (C5H16O4N2) và Y (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam hỗn hợp E gồm hai muối Z và T (MZ < MT) và 4,48 lít (đktc) hỗn hợp M gồm hai amin đồng đẳng kế tiếp có tỉ khối hơi so với H2 bằng 18,3. Khối lượng của muối T trong E là
A. 4,24 gam.
B. 3,18gam.
C. 5,36 gam.
D. 8,04 gam.
Cho 10 gam hỗn hợp gồm Fe và FeO phản ứng hoàn toàn với dung dịch H2SO4 loãng người ta thu được 1,12 lit khí ở đktc.
1. Tính khối lượng của mỗi chất có trong hỗn hợp?
2. Tính khối lượng dung dịch H2SO4 9,8% cần dùng để phản ứng hết với hỗn hợp trên?
Ta có:
n H2 = 0,05 ( mol )
1.PTHH
Fe + H2SO4 ====> FeSO4 + H2
FeO + H2SO4 ====> FeSO4 + H2O
theo pthh: n Fe = n H2 = 0,05 ( mol )
=> m Fe = 2,8 ( g )
=> m FeO = 7,2 ( g ) => n FeO = 0,1 ( mol )
2.
theo pthh: n H2SO4 = 0,05 + 0,1 = 0,15
=> m H2SO4 = 14,7 ( g )
=> m dd H2SO4 9,8% = 150 ( g )
Đúng 1
Bình luận (0)
Cho 5,04 lít hỗn hợp X (đktc) gồm C2H2 và H2 qua Ni đun nóng, thu được hỗn hợp khí Y
gồm ba hiđrocacbon có tỉ khối so với H2 bằng 14,25. Cho Y phản ứng hoàn toàn với dung dịch
Br2 dư. Số mol Br2 đã tham gia phản ứng là
A. 0,075 mol.
B. 0,05.
C. 0,125.
D. 0,025.
Đáp án A
V = 5,04l => n = 0,225 mol
n(C2H2) = x
n(H2) = y
m= 26x + 2y
28,5 = (26x+2y)/x
x+y = 0,225
=> x = 0,1mol
y= 0,125 mol
n(liên kết pi) = 0,2 mol
=> n(Br2) = 0,2 - 0,125 = 0,075 mol
Đúng 0
Bình luận (0)
Cho 12,55 gam hỗn hợp chất rắn X gồm FeCO3, MgCO3 và Al2O3 tác dụng hoàn toàn với dung dịch H2SO4 và
NO
3
-
NaNO3 (trong đó tỉ lệ mol của H2SO4 và NaNO3 tương ứng là 19 : 1) thu được dung dịch Y (không chứa ion và 0,11 mol hỗn hợp khí Z gồm NO, CO2, NO2 có tỉ khối so với H2 là 239/11. Cho Y tác dụng với dung dịch NaOH đến khi thu được kết tủa cực đại thì có 0,37 ml NaOH tham gia phản ứng. Mặt khác, khi cho Y tác dụng với dung dịch NaOH...
Đọc tiếp
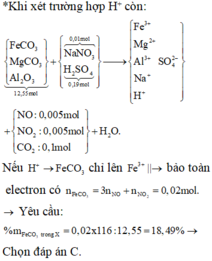
Cho 12,55 gam hỗn hợp chất rắn X gồm FeCO3, MgCO3 và Al2O3 tác dụng hoàn toàn với dung dịch H2SO4 và NO 3 - NaNO3 (trong đó tỉ lệ mol của H2SO4 và NaNO3 tương ứng là 19 : 1) thu được dung dịch Y (không chứa ion và 0,11 mol hỗn hợp khí Z gồm NO, CO2, NO2 có tỉ khối so với H2 là 239/11. Cho Y tác dụng với dung dịch NaOH đến khi thu được kết tủa cực đại thì có 0,37 ml NaOH tham gia phản ứng. Mặt khác, khi cho Y tác dụng với dung dịch NaOH dư đun nóng không thấy khí bay ra. Phần trăm khối lượng của FeCO3 trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
A. 45
B. 40
C. 20
D. 15
Cho 12,55 gam hỗn hợp chất rắn X gồm FeCO3, MgCO3 và Al2O3 tác dụng hoàn toàn với dung dịch H2SO4 và NaNO3 (trong đó tỉ lệ mol của H2SO4 và NaNO3 tương ứng là 19 : 1) thu được dung dịch Y (không chứa ion
NO
3
-
và 0,11 mol hỗn hợp khí Z gồm NO, CO2, NO2 có tỉ khối so với H2 là 239/11. Cho Y tác dụng với dung dịch NaOH đến khi thu được kết tủa cực đại thì có 0,37 ml NaOH tham gia phản ứng. Mặt khác, k...
Đọc tiếp
Cho 12,55 gam hỗn hợp chất rắn X gồm FeCO3, MgCO3 và Al2O3 tác dụng hoàn toàn với dung dịch H2SO4 và NaNO3 (trong đó tỉ lệ mol của H2SO4 và NaNO3 tương ứng là 19 : 1) thu được dung dịch Y (không chứa ion NO 3 - và 0,11 mol hỗn hợp khí Z gồm NO, CO2, NO2 có tỉ khối so với H2 là 239/11. Cho Y tác dụng với dung dịch NaOH đến khi thu được kết tủa cực đại thì có 0,37 ml NaOH tham gia phản ứng. Mặt khác, khi cho Y tác dụng với dung dịch NaOH dư đun nóng không thấy khí bay ra. Phần trăm khối lượng của FeCO3 trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
A. 45
B. 40
C. 20
D. 15
Đáp án A
*Bài toán phụ: NaOH xử lí dung dịch sau phản ứng!
Giả sử có 19x mol H2SO4 → số mol NaNO3 là x mol.

Ø Bài này chỉ nằm ở vấn đề H+ còn dư sau phản ứng hay không? Thực sự đạt được điểm câu này hay không phụ thuộc vào “may mắn” là bạn nghĩ rồi xét trường hợp nào trước. Thật vậy???
*Khi xét trường hợp H+ còn:


Vậy đáp án nào đúng? Hay cả hai đều đúng.! Rõ là TH sau chắc chắn đúng rồi (vì giải chi tiết đến cuối).
Còn TH đầu thì sao? Nếu giải tiếp, liệu các số liệu tiếp còn ổn? vậy, cùng giải tiếp TH đầu:
Bảo toàn C có 0,08 mol MgCO 3 số mol Al2O3 còn lại 0,0344 mol (số liệu gần bằng).
Bảo toàn điện tích có số mol H + dư = 0,19x2 – 0,02x3 – 0,08x2 – 0,0344x6 – 0,01=-0,0564mol?
ồ, vậy là đến đây, số liệu đã chứng tỏ không phù hợp.! Vậy, chọn đáp án A là đáp án cuối cùng.
*Nhận xét: Một bài tập thực sự khó!
Đúng 0
Bình luận (0)