trộn V ml dd NaOH 0,01M với V ml dd HCl 0,03M thu đựoc 2V ml dd Y có pH là bn ??
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH là
Ví dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằng
Ví dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH là
Ví dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là
Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H2SO4 0,0375M và HCl 0,0125M thu được dd có pH là
Ví dụ 8: Trộn lẫn 2 dd có thể tích bằng nhau của dd HCl 0,2M và dd Ba(OH)2 0,2M. pH của dd thu được là
Ví dụ 9: Trộn hai thể tích dd HCl 0,1M với một thể tích dd gồm NaOH 0,2M và Ba(OH)2 0,15M thu được dd Z có pH là
Ví dụ 10: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 x mol/l thu được 500 ml dd có pH=2. Giá trị của x là
Ví dụ 11: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 a mol/l thu được 500 ml dd có pH=12. Giá trị của a là
Ví dụ 12: Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH bằng
Ví dụ 13: Trung hòa 300 ml dung dịch hỗn hợp HCl và HNO3 có pH=2 cần V ml dung dịch NaOH 0,02M. Giá trị của V là
Ví dụ 14: Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4?
Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2
Ví dụ 3 :
n NaOH = 0,01.0,001V(mol)
n HCl = 0,03.0,001V(mol)
$HCl + NaOH \to NaCl + H_2O$
n HCl dư = 0,03.0,001V - 0,01.0,001V = 0,02.0,001V(mol)
Suy ra :
[H+ ] = CM HCl dư = 0,02.0,001V/0,002V = 0,01(M)
=> pH = -log(0,01) = 2
Ví dụ 4 :
n HCl = 0,02.0,05 = 0,001(mol)
n H2SO4 = 0,02.0,075 = 0,0015(mol)
=> n H+ = 0,001 + 0,0015.2 = 0,004(mol)
V dd = 0,02 + 0,02 = 0,04(ml)
=> [H+ ] = 0,004/0,04 = 0,1M
=> pH = - log(0,1) = 1
Trộn lẫn V(ml) dung dịch NaOH 0,01M với V(ml) dung dịch HCl 0,03M thu được 2V (ml) dung dịch Y. Dung dịch Y có pH là
A. 4
B. 1
C. 2
D. 3
Chọn đáp án C
Cho V = 1 lít để xử lý cho dễ hiểu các bạn nhé !
Ta có
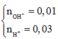
![]()
![]()
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 1.
B. 2.
C. 3.
D. 4.
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 2
B. 3
C. 4
D. 1
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 2.
B. 3.
C. 4.
D. 1.
Đáp án A
nOH– = 0,01V mol; nH+ = 0,03V mol || H+ + OH– → H2O ⇒ H+ dư.
⇒ nH+ dư = 0,02V mol ⇒ [H+dư] = 0,02V ÷ 2V = 0,01
⇒ pH = -log0,01 = 2
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 2.
B. 3.
C. 4
D. 1
Đáp án A
nOH– = 0,01V mol; nH+ = 0,03V mol || H+ + OH– → H2O ⇒ H+ dư.⇒ nH+ dư = 0,02V mol ⇒ [H+dư] = 0,02V ÷ 2V = 0,01 ⇒ pH = -log0,01 = 2
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 1.
B. 2.
C. 3.
D. 4.
:Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M, thu được 2V ml dung dịch Y. Dung dịch Y có pH bằng
\(n_{OH^-}=0.01\cdot10^{-3}\cdot V\left(mol\right)\)
\(n_{H^+}=0.03\cdot10^{-3}\cdot V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(n_{H^+\left(dư\right)}=0.03\cdot10^{-3}V-0.01\cdot10^{-3}V=0.02\cdot10^{-3}V\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.02\cdot10^{-3}}{2}=0.01\cdot10^{-3}=10^{-5}\)
\(pH=-log\left(10^{-5}\right)=5\)
$n_{NaOH} = 0,001V.0,01(mol) < n_{HCl} = 0,001V.0,03(mol)$
Do đó axit dư
$NaOH + HCl \to NaCl + H_2O$
$n_{H^+\ dư} = n_{HCl\ dư} = 0,001V.0,03 - 0,001V.0,01 = 0,001V.0,02(mol)$
$[H^+] = \dfrac{0,001V.0,02}{0,002V} = 0,01$
$pH = -log(0,01) = 2$
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH là
A. 2
B. 3
C. 4
D. 1