Chia hỗn hợp hai kim loại A B có hóa trị không đổi thành hai phần bằng nhau.phần một tan hết trong dd HCL tạo ra 1,792 lít H2 (dktc).phần hai nung trong oxy thu được 2.84 gam hỗn hợp oxit.Khối lượng hỗn hợp hai kim loại trong hỗn hợp đầu:

Những câu hỏi liên quan
Câu 2: Chia hỗn hợp 2 kim loại A,B có hóa trị không đổi thành 2 phần bằng nhau. Phần 1 tan hết trong dung dịch HCl, tạo ra 1,792 lít H2 (đktc), phần 2 nung trong oxy thu được 2,84 gam hỗn hợp oxit. Khối lượng hỗn hợp hai kim loại trong hỗn hợp đầu là?
Theo gt ta có: $n_{H_2}=0,08(mol)$
Bảo toàn e ta có: $n_{e}=0,16(mol)\Rightarrow n_{O_2}=\frac{n_e}{4}=0,04(mol)$
Do đó $m_{kl}=2,84-0,04.32=1,56(g)$
Suy ra $m_{klbđ}=2.1,56=3,12(g)$
Đúng 2
Bình luận (0)
Đặt M là KL chung có hóa trị là n
nH2=0,08
2M + 2nHCl --> 2MCln + nH2
0,16/n <-- 0,16 <-- 0,16/n <--0,08
4M + nO2 --> 2M2On
0,16/n --> 0,08/n
Bảo toàn nguyên tố Oxi: nO trong M2On = (0,08/n).n= 0,08 mol
-> nO2=0,08/2=0,04 mol --> mO2= 0,04.32=1,28g
Bảo toàn khối lượng: mM = mM2On - mO2= 2,84-1,28= 1,56g
Đúng 0
Bình luận (1)
Chia 2m gam hỗn hợp X gồm hai kim loại có hoá trị không đổi thành 2 phần bằng nhau. Cho phần 1 tan hết trong dung dịch HCl (dư) thu được 2,688 lít H2. Nung nóng phần 2 trong oxi (dư) thu được 4,26 gam hỗn hợp oxit. Giá trị của m là A. 4,68 B. 1,17 C. 3,51 D. 2,34.
Đọc tiếp
Chia 2m gam hỗn hợp X gồm hai kim loại có hoá trị không đổi thành 2 phần bằng nhau. Cho phần 1 tan hết trong dung dịch HCl (dư) thu được 2,688 lít H2. Nung nóng phần 2 trong oxi (dư) thu được 4,26 gam hỗn hợp oxit. Giá trị của m là
A. 4,68
B. 1,17
C. 3,51
D. 2,34.
Chọn đáp án D
BTE Þ nO = nH2 Þ m = mOxit - mO = 4,26 - 0,12x16 = 2,34
Đúng 0
Bình luận (0)
Chia m gam hỗn hợp 2 kim loại X và Y có hoá trị không đổi thành 2 phần bằng nhau. Phần 1 hoà tan hết trong dung dịch H2SO4 loãng thu được 1,792 lít khí H2 (đktc). Phần 2 nung trong oxi đến khối lượng không đổi thu được 2,84 gam hỗn hợp oxit. Giá trị của m là: A. 1,56 gam. B. 2,20 gam. C. 3,12 gam. D. 4,40gam.
Đọc tiếp
Chia m gam hỗn hợp 2 kim loại X và Y có hoá trị không đổi thành 2 phần bằng nhau. Phần 1 hoà tan hết trong dung dịch H2SO4 loãng thu được 1,792 lít khí H2 (đktc). Phần 2 nung trong oxi đến khối lượng không đổi thu được 2,84 gam hỗn hợp oxit. Giá trị của m là:
A. 1,56 gam.
B. 2,20 gam.
C. 3,12 gam.
D. 4,40gam.
Chia m gam hỗn hợp 2 kim loại X và Y có hoá trị không đổi thành 2 phần bằng nhau. Phần 1 hoà tan hết trong dung dịch H2SO4 loãng thu được 1,792 lít khí H2 (đktc). Phần 2 nung trong oxi đến khối lượng không đổi thu được 2,84 gam hỗn hợp oxit. Giá trị của m là: A. 1,56 gam B. 2,20 gam C. 3,12 gam D. 4,40gam
Đọc tiếp
Chia m gam hỗn hợp 2 kim loại X và Y có hoá trị không đổi thành 2 phần bằng nhau. Phần 1 hoà tan hết trong dung dịch H2SO4 loãng thu được 1,792 lít khí H2 (đktc). Phần 2 nung trong oxi đến khối lượng không đổi thu được 2,84 gam hỗn hợp oxit. Giá trị của m là:
A. 1,56 gam
B. 2,20 gam
C. 3,12 gam
D. 4,40gam
Cho 7,22 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi. Chia hỗn hợp thành 2 phần bằng nhau, hòa tan hết phần 1 trong dung dịch HCI dư thu được 2,128 lít H2. Hòa tan hết phần 2 trong HNO3 thu được 1,792 lít NO. Tìm M? A. Cu B. Mg C.Zn D. Al
Đọc tiếp
Cho 7,22 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi. Chia hỗn hợp thành 2 phần bằng nhau, hòa tan hết phần 1 trong dung dịch HCI dư thu được 2,128 lít H2. Hòa tan hết phần 2 trong HNO3 thu được 1,792 lít NO. Tìm M?
A. Cu
B. Mg
C.Zn
D. Al
Đáp án D
Gọi n là hóa trị của M. Khối lượng hỗn hợp ở mỗi phần là 3,61 gam, và nNO=0,08.
* Quá hình nhường và nhận electron khi hòa tan phần 1 vào dung dịch HCl dư:
Qúa trình nhường electron:
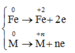
Quá trình nhận electron:
![]()
* Quá trình nhường và nhận electron khi hòa tan phần 2 vào dung dịch HNO3:
Quá trình nhường electron
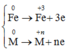
Quá trình nhận electron:
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
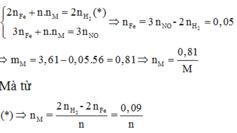
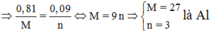
Đúng 0
Bình luận (0)
Cho 7,22 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi. Chia hỗn hợp thành 2 phần bằng nhau, hòa tan hết phần 1 trong dung dịch HCI dư thu được 2,128 lít H2. Hòa tan hết phần 2 trong HNO3 thu được 1,792 lít NO. Tìm M? A. Cu B. Mg C.Zn D. Al
Đọc tiếp
Cho 7,22 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi. Chia hỗn hợp thành 2 phần bằng nhau, hòa tan hết phần 1 trong dung dịch HCI dư thu được 2,128 lít H2. Hòa tan hết phần 2 trong HNO3 thu được 1,792 lít NO. Tìm M?
A. Cu
B. Mg
C.Zn
D. Al
Đáp án D
Gọi n là hóa trị của M. Khối lượng hỗn hợp ở mỗi phần là nH2=3,61 gam, và nNO=0,08.
* Quá hình nhường và nhận electron khi hòa tan phần 1 vào dung dịch HCl dư:
Quá trình nhường e:
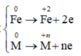
Quá trình nhận e:
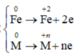
* Quá trình nhường và nhận electron khi hòa tan phần 2 vào dung dịch HNO3:
Quá trình nhường e:
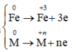
Quá trình nhận e:
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
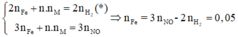
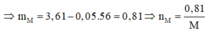
Mà từ
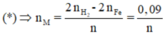
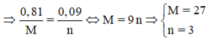
Là Al
Đúng 0
Bình luận (0)
Bài 1: chia hỗn hợp hai kim loại A, B có hóa trị không đổi thành 2 phần bằng nhau. Phần 1 hòa tan hết trong dung dịch HCL, thu được 1,792 lít khí H2 dktc. Phần 2 nung trong oxi thu được 2,84 g hỗn hợp các oxit khối lượng . Hỗn hợp 2 kim loại trong hỗn hợp đầu là?
Bài 2: Cho m gam hỗn hợp Mg và Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và H2 SO4 0,5M thu được 5,32 lít H2 (dktc) và dung dịch Y (xem thể tích dung dịch là không đổi). Dung dịch Y có pH là?
Đọc tiếp
Bài 1: chia hỗn hợp hai kim loại A, B có hóa trị không đổi thành 2 phần bằng nhau. Phần 1 hòa tan hết trong dung dịch HCL, thu được 1,792 lít khí H2 dktc. Phần 2 nung trong oxi thu được 2,84 g hỗn hợp các oxit khối lượng . Hỗn hợp 2 kim loại trong hỗn hợp đầu là?
Bài 2: Cho m gam hỗn hợp Mg và Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và H2 SO4 0,5M thu được 5,32 lít H2 (dktc) và dung dịch Y (xem thể tích dung dịch là không đổi). Dung dịch Y có pH là?
Câu 1:
Phần 1
\(n_{H2}=\frac{1,792}{22,4}=0,08\left(mol\right)\)
Bảo toàn e ta có
\(n_{e\left(nhuong\right)}=0,08.2=0,16\left(mol\right)\)
Phần 2
Bảo toàn e ta có
\(n_{e\left(nhuong\right)}=4n_{O2}\Rightarrow n_{O2}=\frac{0,16}{4}=0,04\left(mol\right)\)
Theo ĐLBLKL
\(m_{kl}+m_{O2}=m_{oxit}\Rightarrow m_{kl}=1,56\)
\(\Rightarrow m_{hh\left(bđ\right)}=1,56.2=3,12\left(g\right)\)
Câu 2:
PT thu gọn:
\(Mg+2H^+\rightarrow Mg+H_2\)
\(Al+6H^+\rightarrow Al+3H_2\)
\(n_{H2}=\frac{5,32}{22,4}=0,2375\left(mol\right)\)
\(\Rightarrow n_{H^+\left(pu\right)}=0,2375.2=0,475\left(mol\right)\)
\(n_{H^+\left(dư\right)}=n_Y=n_{H^+\left(đc\right)}-n_{H^+\left(pư\right)}\)
\(=0,25.\left(1+0,5.2\right)-0,475\)(H2SO4 có hai H nên x2)
\(=0,025\left(mol\right)\)
\(CM_Y=\frac{0,025}{0,25}=0,1M\)
\(pH_{\left(ddY\right)}=-log\left(0,1\right)=1\)
Đúng 1
Bình luận (0)
Chia hỗn hợp 2 kim loại A,B có hóa trị không đổi thành 2 phần bằng nhau.
Phần 1 tan hết trong dung dịch HCL tạo ra 1,792 lít khí H2 (đktc).
Phần 2 nung nóng Oxi dư được 2,84 gam hỗn hợp Oxit.
Tính khối lượng hỗn hợp kim loại ban đầu.
Đặt M là KL chung có hóa trị là n
nH2=0,08
2M + 2nHCl --> 2MCln + nH2
0,16/n <-- 0,16 <-- 0,16/n <--0,08
4M + nO2 --> 2M2On
0,16/n --> 0,08/n
Bảo toàn nguyên tố Oxi: nO trong M2On = (0,08/n).n= 0,08 mol
-> nO2=0,08/2=0,04 mol --> mO2= 0,04.32=1,28g
Bảo toàn khối lượng: mM = mM2On - mO2= 2,84-1,28= 1,56g
Đúng 0
Bình luận (0)
Cho 6,06 gam hỗn hợp X gồm một kim loại kiềm M và một kim loại R có hóa trị III vào nước, thấy hỗn hợp X tan hoàn toàn tạo ra dung dịch A và 3,808 lít khí (đktc). Chia dung dịch A làm hai phần bằng nhau: – Cô cạn phần thứ nhất thu được 4,48 gam chất rắn khan. – Thêm V lít dung dịch HCl 1M vào phần thứ hai thấy xuất hiện 0,78 gam kết tủa. a. Xác định tên hai kim loại và tính thành phần % khối lượng mỗi kim loại trong X. b. Tính giá trị V.
Đọc tiếp
Cho 6,06 gam hỗn hợp X gồm một kim loại kiềm M và một kim loại R có hóa trị III vào nước, thấy hỗn hợp X tan hoàn toàn tạo ra dung dịch A và 3,808 lít khí (đktc). Chia dung dịch A làm hai phần bằng nhau:
– Cô cạn phần thứ nhất thu được 4,48 gam chất rắn khan.
– Thêm V lít dung dịch HCl 1M vào phần thứ hai thấy xuất hiện 0,78 gam kết tủa.
a. Xác định tên hai kim loại và tính thành phần % khối lượng mỗi kim loại trong X.
b. Tính giá trị V.
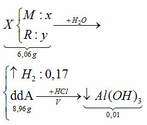
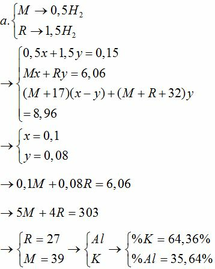
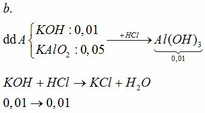
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml
Đúng 0
Bình luận (0)
















