Hòa tan 1 kim loại chưa biết hóa trị vào ddHCl 2,5M thu đc 6,72 lít khí C{đktc} và dd A có chứa 26,7g muối. Xác định kim loại đem dùng

Những câu hỏi liên quan
Câu 5: Hòa tan 5,98 gam kim loại R ( chưa rõ hóa trị ) vào nước dư, thu được 2,912 lít H2 (đktc). Xác định tên kim loại đem dùng?
Gọi hóa trị của kim loại R là x (x > 0)
n H2 = 2,912/22,4 = 0,13 (mol)
PTPƯ: 2R + 2xH2O -> 2R(OH)x + xH2
Theo ptpư: n R = 2/x n H2 = 2/x . 0,13 = 0,26/x (mol)
M R = m R/n R = 5,98/(0,26/x) = 23x
Với x=1 -> R = 23 (Na)
Đúng 2
Bình luận (5)
Gọi n là hóa trị của R (x \(\ge\) I)
PT: 2R + 2nH2O ---> 2R(OH)n + nH2
Ta có: \(n_{H_2}=\dfrac{2,912}{22,4}=0,13\left(mol\right)\)
Theo PT: nR = \(\dfrac{2}{n}.n_{H_2}=\dfrac{2}{n}.0,13=\dfrac{0,26}{n}\)(mol)
=> MR = \(\dfrac{5,98}{\dfrac{0,26}{x}}\) = 23n (g/mol)
Biện luận:
| n | 1 | 2 | 3 |
| MR | 23 (Tm) | 46 (loại) | 69 (loại) |
Vậy R là Natri (Na)
Đúng 0
Bình luận (0)
1, cho 14,2g P2O4 vào cốc chứa 45g nước tạo ra dd axit
a, chất nào còn dư và dư bao nhiêu gram
b, tính khối lượng axit thu được
2, hòa tan 4g kim loại hóa trị II vào nc thu đc 2,24 lít H2 (đktc) xác định tên kim loại
3, hòa tan 15,6g kim loại hóa trị I vào nước thu đc 4,48 lít khí H2 xác định tên kim loại
2) Gọi kim loại hóa trị II là x
X + 2H2O → X(OH)2 + H2
nH2 = 2,24:22,4 =0,1 mol
nX = \(\dfrac{4}{^MX}\)=nH2
=> \(\dfrac{4}{^MX}\)=0,1 => MX=40 => X là kim loại Canxi (Ca)
Đúng 3
Bình luận (0)
Bài 1:
a, Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{45}{18}=2,5\left(mol\right)\)
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{2,5}{3}\), ta được H2O dư.
Theo PT: \(n_{H_2O\left(pư\right)}=3n_{P_2O_5}=0,3\left(mol\right)\)
\(\Rightarrow n_{H_2O\left(dư\right)}=2,5-0,3=2,2\left(mol\right)\)
\(\Rightarrow m_{H_2O\left(dư\right)}=2,2.18=39,6\left(g\right)\)
b, Theo PT: \(n_{H_3PO_4}=2n_{P_2O_5}=0,2\left(mol\right)\)
\(\Rightarrow m_{H_3PO_4}=0,2.98=19,6\left(g\right)\)
Bạn tham khảo nhé!
Đúng 3
Bình luận (0)
Bài 2: Giả sử KL cần tìm là A.
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(A+2H_2O\rightarrow A\left(OH\right)_2+H_2\)
___0,1___________________0,1 (mol)
\(\Rightarrow M_A=\dfrac{4}{0,1}=40\left(g/mol\right)\)
Vậy: A là Canxi (Ca).
Bài 3:
Giả sử kim loại cần tìm là B.
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2B+2H_2O\rightarrow2BOH+H_2\)
___0,4__________________0,2 (mol)
\(\Rightarrow M_B=\dfrac{15,6}{0,4}=39\left(g/mol\right)\)
Vậy: B là Kali (K).
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
hh d gồm fe và 1 kim loại m có hóa trị 2. hòa tan 9,6g hh d vào đ hcl dư.thì thu đc 4,48l khí (đktc). mặt khác khi hòa tan hoàn toàn 4,6g kim loại vào dd hcl dư thì thể tích h2 sinh ra chứa đến 5,6l (đktc). xác định kim loại m và tính khối lượng mỗi kim loại có trong hh
Gọi nFe=a(mol);nM=b(mol)⇒56a+Mb=9,6(1)
Fe+2HCl→FeCl2+H2
M+2HCl→MCl2+H2
nH2=a+b=0,2⇒a=0,2−b
Ta có :
56a+Mb=9,656a+Mb=9,6
⇔56(0,2−b)+Mb=9,6
⇔Mb−56b=−1,6
⇔b(56−M)=1,6
0<1,656−M<0,20<1,656−M<0,2
⇔M<48(1)
M+2HCl→MCl2+H2
⇒MM>4,60,25=18,4
+) Nếu M=24(Mg)
Ta có :
56a+24b=9,656a+24b=9,6
a+b=0,2a+b=0,2
Suy ra a = 0,15 ; b = 0,05
mFe=0,15.56=8,4(gam)
mMg=0,05.24=1,2(gam)
+) Nếu M=40(Ca)
56a+40b=9,656a+40b=9,6
a+b=0,2
Suy ra a = b = 0,1
mCa=0,1.40=4(gam)
mFe=0,1.56=5,6(gam)
Đúng 0
Bình luận (0)
Bài tập 1: Hòa tan hoàn toàn 2,8 gam kim loại A (chưa rõ hóa trị) bằng dung dịch H2SO4 loãng, dư. sau phản ứng thu được 6,72 lít khí H2(đktc). Xác định kim loại A.
nH2 = 0,3 mol
2A + nH2SO4 → A2(SO4)n + nH2
0,6/n ← 0,3 mol
mA = 2,8 gam, nA = 0,6/n
→ MA = 2,8.n/0,6 = 14n/3, xét các giá trị n = 1, 2, 3 để suy ra MA
Với đề bài này thì không ra được đáp án nhé.
Đúng 4
Bình luận (0)
Cho 5,4 gam kim loại X hóa trị III hòa tan hết vào dung dịch HCl thu được 6,72 lít khí H2 (đktc)
a)Lập PTHH của phản ứng.
b)Xác định kim loại X.
c) Tính khối lượng muối XCl3 tạo thành
\(a,PTHH:2X+6HCl\to 2XCl_3+3H_2\\ b,n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ \Rightarrow n_{X}=\dfrac{2}{3}n_{H_2}=0,2(mol)\\ \Rightarrow M_{X}=\dfrac{5,4}{0,2}=27(g/mol)\)
Vậy X là nhôm (Al)
\(c,n_{AlCl_3}=n_{Al}=0,2(mol)\\ \Rightarrow m_{AlCl_3}=0,2.133,5=26,7(g)\)
Đúng 0
Bình luận (0)
Hoà tan 16,8g kim loại vào dung dịch HCl dư, sau phản ứng thu được 6,72 lít khí H 2 (đktc). Kim loại đem hoà tan là (Biết trong muối thu được sau phản ứng kim loại có hóa trị II)
A. Mg
B. Zn
C. Pb
D. Fe
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại ABài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Đọc tiếp
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
Đúng 1
Bình luận (0)
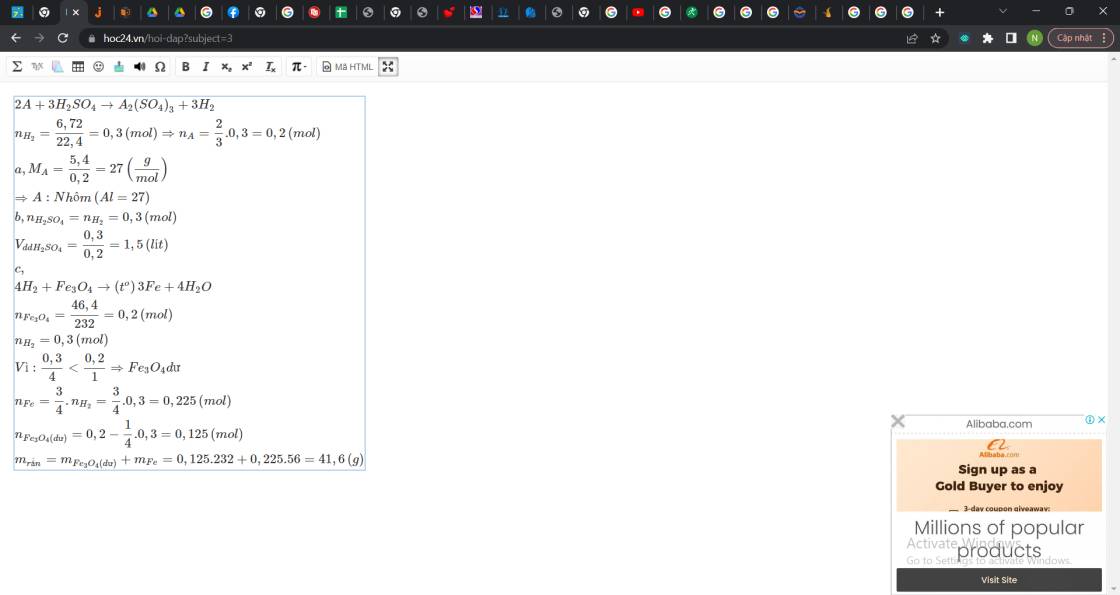
Hòa tan 5,4g một kim loại A hóa trị III vào dung dịch H2SO4 lượng dư. Sau p/ứ thu được 6,72 lít khí H2 (đktc). a) Xác định kim loại A b) tính thể tích dung dịch axit sunfuric 0,2M cần dùng cho phản ứng c) nếu dẫn lượng khí thu được ở phản ứng trên qua bình đựng 46,4g fe2o3. tính khối lượng chất rắn th...
Đọc tiếp
Hòa tan 5,4g một kim loại A hóa trị III vào dung dịch H2SO4 lượng dư. Sau p/ứ thu được 6,72 lít khí H2 (đktc). a) Xác định kim loại A b) tính thể tích dung dịch axit sunfuric 0,2M cần dùng cho phản ứng c) nếu dẫn lượng khí thu được ở phản ứng trên qua bình đựng 46,4g fe2o3. tính khối lượng chất rắn thu được sau phản ứng
\(2A+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\Rightarrow n_A=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ a,M_A=\dfrac{5,4}{0,2}=27\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)\\ V_{ddH_2SO_4}=\dfrac{0,3}{0,2}=1,5\left(lít\right)\\ c,\\ 3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\ n_{Fe_3O_4}=\dfrac{46,4}{232}=0,2\left(mol\right)\\ n_{H_2}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{3}< \dfrac{0,2}{1}\Rightarrow Fe_3O_4dư\\ n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Fe_3O_4\left(dư\right)}=0,2-\dfrac{1}{3}.0,3=0,1\left(mol\right)\\ m_{rắn}=m_{Fe_3O_4\left(dư\right)}+m_{Fe}=0,1.232+0,2.56=34,4\left(g\right)\)
Đúng 1
Bình luận (0)
Này mới đúng nè em!
Đúng 0
Bình luận (0)
1,Hòa tan 2,49g hỗn hợp gồm kim loại A(hóa trị II) và Al vào dd HCl dư thu được dd X và 1,68 lít khí H2(đktc).Nếu tiếp tục cho dd NaOH dư vào dd X thì thu được 2,7g kết tủa.
a,Viết các PTHH xảy ra
b,Xác định tên kim loại A
c,Khối lượng muối thu được có trong dd X
a, PTHH:
\(A+2HCl\rightarrow ACl_2+H_2\left(1\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(2\right)\)
\(AlCl_3+4NaOH\rightarrow NaAlO_2+3NaCl+2H_2O\)
b, Ta có \(n_{AlCl_3}=n_{NaAlO_2}=\dfrac{2,7}{82}=0,03\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=n_{AlCl_3}=0,03\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{AlCl_3}=0,045\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=27.0,03=0,81\left(g\right)\\n_A=n_{H_2\left(1\right)}=\dfrac{1,68}{22,4}-n_{H_2\left(2\right)}=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_A=2,49-0,81=1,68\left(g\right)\\n_A=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow M_A=\dfrac{1,68}{0,03}=56\left(g/mol\right)\Rightarrow A\) là \(Fe\)
c, \(m_{\text{muối}}=m_{FeCl_2}+m_{AlCl_3}\)
\(=127.n_{Fe}+133,5.n_{Al}\)
\(=127.0,03+133,5.0,03=7,815\left(g\right)\)
Đúng 3
Bình luận (1)






























