a. Tính số mol của H2SO4 có trong 100ml dung dịch H2SO4 2M
b. Tính khối lượng dung dịch H2SO4 40% cần dùng để pha được 100ml dung dịch H2SO4 2M
a,tính khối lượng NaOH có trong 200ml dung dịch NaOh 1M b,tính số mol H2SO4 có trong 100ml dung dịch H2SO4 2M c,hoà tan 6g NaCl vào nước thu được 200g dung dịch tính nồng độ phần trăm của dung dịch d,tính khối lượng NaCl có trong 200g dung dịch NaCl 8%
a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)
Bài 5. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M thu được dung dịch A. Tính nồng độ mol các chất tan trong dung dịch A.
Bài 6. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M ta thu được dung dịch A. Tính nồng độ mol các chất trong dung dịch A.
Bài 7. Trộn 300ml dung dịch Ba(OH)2 1M với 200ml dung dịch H2SO4 1M ta thu được dung dịch A và mg kết tủa. Tính giá trị của m và nồng độ mol các chất trong dd A.
Bài 8. Trộn 200ml dung dịch Na2CO3 với 300ml dung dịch HCl 1M ta thu được dung dịch A và V lít khí CO2 ở đktc. Tính V và nồng độ mol các chất trong dung dịch A.
các bạn giúp mình với ạ
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Tính thể tích nước cần dung để pha loãng.
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 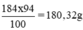
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 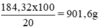
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
Một loại oleum có công thức H2SO4.nSO3. Lấy 33,8 g oleum nói trên pha thành 100ml dung dịch A. Để trung hoà 25 ml dung dịch A cần dùng vừa đủ 100ml dung dịch NaOH 2M. Giá trị của n là
A. 1
B. 2
C. 3
D. 4
Đáp án C
Giải:
nH2SO4=1/2 nNaOH = 0,1 => nH2SO4 tạo thành = 0,4 H2SO4.nSO3+nH2O -> (n+1)H2SO4
=> noleum = 0,4/(n+1) => 98+80n = 33,8(n+1)/0,4 => n=3
để trung hòa 0,2ml dung dịch NaOH cần 100ml dung dịch H2SO4. Tính nồng độ mol của H2SO4 đã dùng?
Tính khối lượng dung dịch H2SO4 40% cần dùng để pha chế được 200ml dung dịch H2SO4 2M
Theo đề bài ta có
Vdd=200ml=0,2 l
Số mol của dung dịch H2SO4 có hòa tan trong 200ml dung dịch H2SO4 2M là :
nH2SO4=CM.V=2.0,2=0,4 mol
\(\Rightarrow\) mct=mH2SO4=0,4.98=39,2 g
\(\Rightarrow\) Khối lượng dung dịch H2SO4 40% cần dùng là :
mdd=\(\dfrac{mct.100\%}{C\%}=\dfrac{39,2.100\%}{40\%}=98g\)
Vậy cần 98g dung dịch H2SO4 40% để pha chế được 200ml dung dịch H2SO4 2M
Ta có: \(V_{ddH_2SO_4}=200\left(ml\right)=0,2\left(l\right)\)
=> \(n_{H_2SO_4}=V_{ddH_2SO_4}.C_{MddH_2SO_4}=0,2.2=0,4\left(mol\right)\)
=> \(m_{H_2SO_4}=0,4.98=39,2\left(g\right)\)
Tính m gam BaCl2.2H2O cần thêm 100ml axit H2SO4 có nồng độ 40% (d=1,3g/ml).Để được dung dịch có phần khối lượng của H2SO4 20%
Trung hòa 100ml dung dịch H2SO4 3M bằng dung dịch KOH 2M
a) Viết PTHH.
b) Tính khối lượng muối thu được.
c) Tính thể tích của dung dịch KOH cần dùng?
d) Tính nồng độ mol/l của dung dịch thu được sau phản ứng?
100ml = 0,1l
\(n_{H2SO4}=3.0,1=0,3\left(mol\right)\)
a) Pt : \(H_2SO_4+2KOH\rightarrow K_2SO_4+2H_2O|\)
1 2 1 2
0,3 0,6 0,3
b) \(n_{K2SO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
⇒ \(m_{K2SO4}=0,3.174=52,2\left(g\right)\)
c) \(n_{KOH}=\dfrac{0,3.2}{1}=0,6\left(mol\right)\)
\(V_{ddKOH}=\dfrac{0,6}{2}=0,3\left(l\right)\)
d) \(V_{ddspu}=0,1+0,3=0,4\left(l\right)\)
\(C_{M_{K2SO4}}=\dfrac{0,3}{0,4}=0,75\left(M\right)\)
Chúc bạn học tốt
Cho m gam Cao hòa tan hoàn toàn trong 100ml dung dịch H2SO4 2M câu a tính khối lượng muối thu được câu b tính giá trị m gam câu c nếu cho cùng lượng CaO trên vào 80 gam dung dịch H2SO4 C% phản ứng xảy ra hoàn toàn tính giá trị C%
\(n_{H_2SO_4}=0,1.2=0,2\left(mol\right)\\ CaO+H_2SO_4\rightarrow CaSO_4+H_2O\\ 0,2.........0,2........0,2\left(mol\right)\\ a.m_{CaSO_4}=136.0,2=27,2\left(g\right)\\ b.m=m_{CaO}=0,2.56=11,2\left(g\right)\\ c.n_{H_2SO_4}=n_{CaO}=0,2\left(mol\right)\\ C\%=C\%_{ddH_2SO_4}=\dfrac{0,2.98}{80}.100=24,5\%\)
Số mol H 2 SO 4 cần dùng để pha chế 10 ml dung dịch H 2 SO 4 2M là
A. 0,2 mol.
B. 5,0 mol.
C. 20,0 mol.
D. 0,02 mol.
Đáp án D
n H 2 SO 4 = 0 , 01 . 2 = 0 , 02 mol