cho 5,6 lít hỗn hợp khí ( đktc ) gồm CH4 và C2H4 có tỉ lệ thể tích 3:2 qua dung dịch chứa 20 gam brom. Khối lượng brom còn dư là ( biết phản ứng xảy ra hoàn toàn )

Những câu hỏi liên quan
Cho 5,6 lít hỗn hợp khí (đktc) gồm c2h4 và c2h2 có tỉ lệ thể tích là 3: 2 tác dụng với dung dịch brom dư. khối lượng brom đã tham gia phản ứng là(Biết phản ứng xảy ra hoàn toàn) (Cho NTK: C = 12; H = 1; Br = 80 )
A. 64 gam
B. 24 gam.
C. 16 gam.
D. 56 gam.
cho 5,6 lít hỗn hợp khí ở đktc gồm CH4 và C2H4 đi qua bình đựng dung dịch Brom dư, thì khối lượng brom tham gia phản ứng là 16g
a)Viết PTHH
b)tính phần trăm thể tích mỗi khí trong hỗn hợp ban đầu
c)đốt cháy hoàn toàn 5,6lits hỗn hợp khí trên và dẫn toàn bộ sản phẩm qua dung dịch Ca(OH)2 dư, tính khối lượng kết tủa thu đc sau phản ứng
ta có :
nBr2=\(\dfrac{16}{160}=0,1mol\)
C2H4+Br2->C2H4Br2
0,1------0,1
=>VC2H4=0,1.22,4=2,24l
=>VCH4=3,36l->n CH4=0,15 mol
->%VC2H4=\(\dfrac{2,24}{5,6}.100\)=40%
=>%VCH4=60%
c)
CH4+2O2-to>CO2+2H2O
0,15---------------0,15
C2H4+3O2--to>2CO2+2H2O
0,1--------------------0,2
=>m CaCO3=0,35.100=35g
Đúng 3
Bình luận (0)
cho 7,84 lít hỗn hợp khí X gồm C2H4 và CH4 vào dungb dịch brom, thấy khối lượng brom đã tham gia phản ứng là 24 gam.....
a. Nếu đốt cháy hoàn toàn hỗn hợp khí X thì cần bao nhiêu lít không khí ( chứa 20% thể tích khí oxi
b. Tính tỉ khối của hỗn hợp X đối với không khí. các khíddo ở đktc
a)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$n_{C_2H_4} = n_{Br_2} = \dfrac{24}{160} = 0,15(mol)$
$n_X = \dfrac[7,84}{22,4} = 0,35(mol)$
$\Rightarrow n_{CH_4} = 0,35 - 0,15 = 0,2(mol)$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O$
$n_{O_2} = 2n_{CH_4} + 3n_{C_2H_4} = 0,85(mol)$
$V_{O_2} = 0,85.22,4 = 19,04(lít)$
$V_{không\ khí} = V_{O_2} : 20\% = 95,2(lít)$
b)
$M_X = \dfrac{0,2.16 + 0,15.28}{0,35} = 21,14(g/mol)$
$d_{X/không\ khí} = \dfrac{21,14}{29} = 0,73$
Đúng 0
Bình luận (0)
Hiđrocacbon A, B mạch hở có tỉ khối đối với
H
2
tương ứng là 22 và 13. Dẫn 5,6 lít hỗn hợp A, B có tỉ khối đối với
H
2
là 18,4 qua dung dịch nước brom dư sao cho phản ứng xảy ra hoàn toàn. Hãy tính khối lượng brom đã tham gia phản ứng (biết thể tích khí đo ở đktc).
Đọc tiếp
Hiđrocacbon A, B mạch hở có tỉ khối đối với H 2 tương ứng là 22 và 13. Dẫn 5,6 lít hỗn hợp A, B có tỉ khối đối với H 2 là 18,4 qua dung dịch nước brom dư sao cho phản ứng xảy ra hoàn toàn. Hãy tính khối lượng brom đã tham gia phản ứng (biết thể tích khí đo ở đktc).
Gọi số mol của C 2 H 2 có trong hỗn hợp là x → n C 3 H 8 = 5,6/22,4 - x(mol)
Ta có:
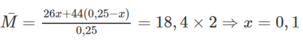
Phương trình hóa học :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vậy m Br 2 đã phản ứng là: 0,2 x 160 = 32(gam)
Đúng 0
Bình luận (0)
cho 5.6 lít hỗn hợp khí C đktc gồm CH4 và C2H4 có tỉ lệ 3: 2 phản ứng vừa đủ với m gam dung dịch Brom 40%
cho 5.6 lít hỗn hợp khí x đktc gồm ch4 và c2h4 có tỉ lệ 3 : 2 phản ứng vừa đủ với m gam dung dịch brom 40%
a/ viết pthh
b/ tính giá trị m
Hỗn hợp khí A gồm CH4 và C2H4. Dẫn hỗn hợp A qua bình đựng dung dịch brom dư, sau phản ứng khối lượng bình brom tăng 9,8 (g). Mặt khác nếu đốt cháy hoàn toàn hỗn hợp khí A cần dùng 34,72 lít khí oxi ( ở đktc). Tính % về thể tích của CH4 và C2H4 trong hỗn hợp A .
Hỗn hợp khí A gồm CH4 và C2H4. Dẫn hỗn hợp A qua bình đựng dung dịch brom dư, sau phản ứng khối lượng bình brom tăng 9,8 (g). Mặt khác nếu đốt cháy hoàn toàn hỗn hợp khí A cần dùng 34,72 lít khí oxi ( ở đktc). Tính % về thể tích của CH4 và C2H4 trong hỗn hợp A . Giải giúp em với ạ :< em đang cần gấp
Dẫn 5,6 lít (đktc) hỗn hợp khí gồm CH4 , C2H4 và C2H2 qua bình Brom dư thấy khối lượng bình đựng dung dịch Brom tăng 5,4 gam . Khí thoát ra khỏi bình được đốt cháy hoàn toàn thu được 2,2 gam CO2 . Tính % về khối lượng của mỗi hiddro cacbon có trong hỗn hợp ?'
Cho hỗn hợp T gồm CH4, C2H4 và C2H2. Lấy 4,3 gam T tác dụng hết với dung dịch brom (dư) thì khối lượng brom phản ứng là 24 gam. Mặt khác, nếu cho 6,72 lít hỗn hợp T (đktc) tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được 18 gam kết tủa. Viết các phương trình phản ứng xảy ra và tính % thể tích mỗi khí trong hỗn hợp T.
Đọc tiếp
Cho hỗn hợp T gồm CH4, C2H4 và C2H2. Lấy 4,3 gam T tác dụng hết với dung dịch brom (dư) thì khối lượng brom phản ứng là 24 gam. Mặt khác, nếu cho 6,72 lít hỗn hợp T (đktc) tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được 18 gam kết tủa. Viết các phương trình phản ứng xảy ra và tính % thể tích mỗi khí trong hỗn hợp T.
a) Các phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
C2H2 + Ag2O → C2Ag2 + H2O
Hay
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3
b) Gọi a, b, c lần lượt là số mol của CH4, C2H4, C2H2 trong 4,3gam hỗn hợp T.
– Số mol Br2 = 0,15 (mol); số mol kết tủa = số mol C2H2 = 0,075 (mol); số mol T = 0,3 (mol). Do đó nT = 4nC2H2
– Ta có hệ phương trình:
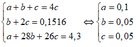
– Suy ra % thể tích mỗi khí trong T:
%VCH4 = 50%; %VC2H2 = %VC2H4 = 25%
Đúng 0
Bình luận (0)
Hỗn hợp A gồm
CH
4
,
C
2
H
2
và một hiđrocacbon X có công thức
C
n
H
2
n
+
2
.Cho 0,8...
Đọc tiếp
Hỗn hợp A gồm CH 4 , C 2 H 2 và một hiđrocacbon X có công thức C n H 2 n + 2 .Cho 0,896 lít hỗn hợp A đi qua dung dịch brom dư để phản ứng xảy ra hoàn toàn, thấy thoát ra 0,448 lít hỗn hợp hai khí. Biết rằng tỉ lệ số mol của CH 4 và C n H 2 n + 2 trong hỗn hợp là 1 : 1, khi đốt cháy 0,896 lít A thu được 3,08 gam khí CO 2 (thể tích khí đo ở đktc). Tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp A.
Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%
Đúng 0
Bình luận (0)





















