đốt cháy 8g đơn chất M cần 5,6 lít O2 ( đkc ). Chất M là?

Những câu hỏi liên quan
Đốt cháy 8 gam đơn chất M cần 5,6 lít O2 (đktc). Chất M là
A. Na.
B. S.
C. C.
D. P.
Đáp án B
Số mol các chất là:
n O 2 = 0 , 25 mol n M = 8 M mol
Gọi hóa trị của M là n
Sơ đồ phản ứng : M 0 + O 2 0 → t 0 M 2 + n O n - 2
Các quá trình nhường, nhận electron :
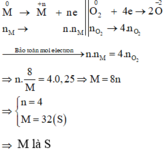
Đúng 0
Bình luận (0)
Đốt cháy 8g đơn chất X cần 5,6 lít O2(đktc). Chất X là>
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
4X + nO2 \(\underrightarrow{to}\) 2X2On
Theo PT: \(n_X=\dfrac{4}{n}n_{O_2}=\dfrac{1}{n}\left(mol\right)\)
\(\Rightarrow M_X=8\div\dfrac{1}{n}=8n\left(g\right)\)
Lập bảng:
| n | 1 | 2 | 3 |
| MX | 8 | 16 | 24 |
| loại | loại | Mg |
Vậy X là magiê Mg
Đúng 0
Bình luận (2)
Đốt cháy hoàn toàn m gam hỗn hợp chất hữu cơ gồm C2H4, C3H6, C4H8 cần vừa đủ V lít khí O2 (đktc), thu được 5,6 lít khí CO2 (đktc). Giá trị của V là: A. 8,4. B. 5,6. C. 11,2. D. 16,8.
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp chất hữu cơ gồm C2H4, C3H6, C4H8 cần vừa đủ V lít khí O2 (đktc), thu được 5,6 lít khí CO2 (đktc). Giá trị của V là:
A. 8,4.
B. 5,6.
C. 11,2.
D. 16,8.
Đốt cháy hoàn toàn 7,2 g kim loại M có hoá trị không đổi cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 g hỗn hợp chất rắn. M là A. Cu. B. Be C. Mg D. Ca
Đọc tiếp
Đốt cháy hoàn toàn 7,2 g kim loại M có hoá trị không đổi cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 g hỗn hợp chất rắn. M là
A. Cu.
B. Be
C. Mg
D. Ca
Giải thích: Đáp án C
Bảo toàn khối lượng m↑ = 23-7,2 =15,8 g
→ hỗn hợp khí có Cl2 : 0,2 mol và O2 :0,05 mol
Đặt hóa trị của M là x
Bảo toàn e có 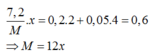
→x=2 và M =24 (Mg)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là A. Ca B. Cu C. Zn D. Mg
Đọc tiếp
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là
A. Ca
B. Cu
C. Zn
D. Mg
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là : A. Cu. B. Be. C. Mg. D. Ca.
Đọc tiếp
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là :
A. Cu.
B. Be.
C. Mg.
D. Ca.
Chọn đáp án C
Đặt nCl2 = x; nO2 = y ⇒ nkhí = x + y = 0,25 mol. Bảo toàn khối lượng:
7,2 + 71x + 32y = 23 ||⇒ giải hệ có: x = 0,2 mol; y = 0,05 mol.
Gọi n là hóa trị của M. Bảo toàn electron: n × nM = 2nCl2 + 4nO2.
⇒ nM = 0,6 ÷ n ⇒ MM = 7,2 ÷ (0,6 ÷ n) = 12n.
⇒ n = 2 và MM = 24 ⇒ M là Magie (Mg) ⇒ chọn C.
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là A. Ca. B. Cu. C. Zn D. Mg.
Đọc tiếp
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là
A. Ca.
B. Cu.
C. Zn
D. Mg.
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là A. Cu B. Be C. Mg D. Ca
Đọc tiếp
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là
A. Cu
B. Be
C. Mg
D. Ca
Đáp án C
Đặt nCl2 = x; nO2 = y ⇒ nkhí = x + y = 0,25 mol.
Bảo toàn khối lượng:
7,2 + 71x + 32y = 23 ||
⇒ giải hệ có: x = 0,2 mol; y = 0,05 mol.
Gọi n là hóa trị của M.
Bảo toàn electron: n × nM = 2nCl2 + 4nO2.
⇒ nM = 0,6 ÷ n
⇒ MM = 7,2 ÷ (0,6 ÷ n) = 12n.
⇒ n = 2 và MM = 24 ⇒ M là Magie (Mg)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp M gồm : ancol X, axit cacboxylic Y và este Z (đều no đơn chức mạch hở và Y, Z có cùng số nguyên tử C) cần dùng vừa đủ 12,32 lít O2 (đkc) sinh ra 11,2 lít CO2 (đkc). Công thức của Z là A. HCOOCH3 B. CH3COOCH3 C. HCOOC2H5 D. CH3COOC2H5
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp M gồm : ancol X, axit cacboxylic Y và este Z (đều no đơn chức mạch hở và Y, Z có cùng số nguyên tử C) cần dùng vừa đủ 12,32 lít O2 (đkc) sinh ra 11,2 lít CO2 (đkc). Công thức của Z là
A. HCOOCH3
B. CH3COOCH3
C. HCOOC2H5
D. CH3COOC2H5
Đáp án A
Gọi công thức của ancol X là Cn H2n+2O và công thức của Y, Z là CmH2mO2 ( với m ≥ 2)
Cn H2n+2O + 1,5n O2 → nCO2 + (n+1) H2O
CmH2mO2 + (1,5m- 1) O2 → m CO2 + mH2O
Thấy nY+ nZ = 1,5nCO2 - nO2 = 1,5. 0,5 - 0,55= 0,2 mol
Luôn có 0,2.m < 0,5 → m < 2,5 → m = 2
Vậy công thức của Z là HCOOCH3
Đúng 0
Bình luận (0)







