cho tui hỏi : 1 quặng sắt chứa 90% Fe3O4 còn lại là tạp chất , nếu dùng khí hidro dể khử 0,5 tấn quặng thì số lượng sắt thu được là bao nhiêu?hi zúp cái nhi tui ko hiểu dạng này .

Những câu hỏi liên quan
Một loại quặng sắt chứa 90% Fe3O4 còn lại là tạp chất ko chứa sắt tính khối lượng quặng còn lại để thu được 25,2(g) sắt
helpppp me ạ
Một quặng sắt chứa 90% Fe3O4 còn lại là tạp chất . Nếu dùng khí H2 để khử 0,5 tấn quặng thì khối lượng sắt thu được là bao nhiêu ?
- Khối lượng Fe3O4 trong 0,5 tấn quặng sắt là :
\(90\%.0,5=0,45\left(tons\right)=450000\left(g\right)\)
=> \(n_{Fe_3O_4}=\frac{m}{M}=\frac{56250}{29}\left(mol\right)\)
PTHH : \(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
Theo PTHH : \(n_{Fe}=\frac{168750}{29}\left(mol\right)\)
=> \(m_{Fe}=325862,069\left(g\right)\approx0,326\left(tons\right)\)
Đúng 0
Bình luận (0)
khử hoàn toàn 0,58 tấn quặng sắt chứa 80 % là Fe3O4 bằng khí hidro . Tính khối lượng sắt thu được ?
\(0,58\left(tấn\right)=580000\left(g\right)\\ \Rightarrow m_{Fe_3O_4}=580000\cdot80\%=464000\left(g\right)\\ \Rightarrow n_{Fe_3O_4}=\dfrac{464000}{232}=2000\left(mol\right)\\ PTHH:Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\\ \Rightarrow n_{Fe}=3n_{Fe_3O_4}=8000\left(mol\right)\\ \Rightarrow m_{Fe}=8000\cdot56=336000\left(g\right)=0,336\left(tấn\right)\)
Đúng 2
Bình luận (0)
Khử hoàn toàn 0,58 tấn quặng sắt chứa 90 % là
F
e
3
O
4
bằng khí hiđro. Khối lượng sắt thu được là: A. 0,378 tấn B. 0,156 tấn C. 0,126 tấn D. 0,467 tấn
Đọc tiếp
Khử hoàn toàn 0,58 tấn quặng sắt chứa 90 % là F e 3 O 4 bằng khí hiđro. Khối lượng sắt thu được là:
A. 0,378 tấn
B. 0,156 tấn
C. 0,126 tấn
D. 0,467 tấn
Chọn A

=> khối lượng F e 3 O 4 có trong quặng là 0,552 (tấn)
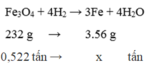
Vậy m F e = ( 0 , 522 . 3 . 56 ) : 232 = 0 , 378 t ấ n .
Đúng 0
Bình luận (0)
Một quặng chứa 90% Fe3O4 còn lại là tạp chất.Nếu dùng khí H2 để khử 0.5 tấn quặng thì khối lượng sắt thu đc là bao nhiêu.
Khối lượng của Fe3O4 trong quặng là: 0,5 * 90% = 0,45 tấn
PTHH: 4H2 + Fe3O4 →3 Fe + 4H2O
...................+ 232 g........3*56 g.................
Vậy khử 450 g Fe3O4 thì đc x g Fe
⇒ x = \(\dfrac{450\cdot3\cdot56}{232}\) = 325,9 g = 0,326 tấn
Vậy....
Đúng 0
Bình luận (2)
1 loại quặng photphat chứa 60% là tạp chất, còn lại là ca3(po4)2. Nếu dùng 20 tấn quặng này thì lượng p2o5 điều chế được là bao nhiêu
\(m_{Ca_3\left(PO_4\right)_2}=20\cdot40\%=8\left(tấn\right)=8000\left(kg\right)\)
\(n_{Ca_3\left(PO_4\right)_2}=\dfrac{8000}{310}=\dfrac{800}{31}\left(kmol\right)\)
Bảo toàn nguyên tố P :
\(n_{P_2O_5}=n_{Ca_3\left(PO_4\right)_2}=\dfrac{800}{31}\left(kmol\right)\)
\(m_{P_2O_5}=\dfrac{800}{31}\cdot142=3664.5\left(kg\right)\)
Đúng 2
Bình luận (0)
$m_{Ca_3(PO_4)_2} = 20.(100\%-60\%) = 8(tấn) = 8000(kg)$
Bảo toàn P
$n_{P_2O_5} = n_{Ca_3(PO_4)_2} = \dfrac{8000}{310}(kmol)$
$m_{P_2O_5} = \dfrac{8000}{310}.142 = 3664,5(kg)$
Đúng 0
Bình luận (0)
Để luyện được 800 tấn gang có hàm lượng sắt 95%, cần dùng x tấn quặng manhetit chứa 80%
Fe
3
O
4
(còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt bị hao hụt trong quá trình sản xuất là 1%. Giá trị của x là A. 1394,90 B. 1325,16 C. 1311,90 D. 959,59
Đọc tiếp
Để luyện được 800 tấn gang có hàm lượng sắt 95%, cần dùng x tấn quặng manhetit chứa 80% Fe 3 O 4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt bị hao hụt trong quá trình sản xuất là 1%. Giá trị của x là
A. 1394,90
B. 1325,16
C. 1311,90
D. 959,59
Để luyện được 800 tấn gang có hàm lượng sắt 95% cần dùng x tấn quặng manhetit chứa 80%
Fe
3
O
4
(còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt hao hụt trong quá trình sản xuất là 1%. Giá trị của x là A. 1235. B. 1325. C. 1324. D. 1650.
Đọc tiếp
Để luyện được 800 tấn gang có hàm lượng sắt 95% cần dùng x tấn quặng manhetit chứa 80% Fe 3 O 4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt hao hụt trong quá trình sản xuất là 1%. Giá trị của x là
A. 1235.
B. 1325.
C. 1324.
D. 1650.
Để luyện được 800 tấn gang có hàm lượng sắt 95% cần dùng x tấn quặng manhetit chứa 80% Fe 3 O 4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt hao hụt trong quá trình sản xuất là 1%. Giá trị của x là
A. 1235
B. 1325
C. 1324
D. 1650



















