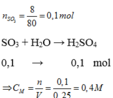Có 1 đ axit sunfuric, trong đó số mol H2SO4 bằng số mol H2O. Tính C% của H2SO4

Những câu hỏi liên quan
cho 1 dd axit sunfuric trong đó số mol H2SO4 =sỐ mol H2O .tính nồng độ %
Giả sử số mol đều là x mol
\(m_{H_2SO_4}=98x\)
\(m_{H_2O}=18x\)
\(C\%_{H_2SO_4}=\dfrac{98x.100}{98x+18x}=\dfrac{9800}{116}\approx85,5\%\)
Đúng 0
Bình luận (1)
Tính số mol của 19,6g của axit sunfuric H2SO4? biết H=1, S= 32, O=16
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2(mol)\)
Đúng 4
Bình luận (0)
\(n_{H_2SO_4}=\dfrac{19.6}{98}=0.2\left(mol\right)\)
Đúng 1
Bình luận (0)
Cho 5,4g nhôm tác dụng với dd chứa axit sunfuric H2SO4 có nồng độ 2M.
a) Tính thể tích dd axit sunfuric H2SO4 tham gia phản ứng ? Sau đó tính nồng độ mol đ tạo thành sau phản ứng. Biết rằng sau phản ứng thể tích thay đổi không đáng kể.
b) Thể tích khí hidro thu được ở đktc?
a)
$n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH:
$n_{H_2SO_4} = n_{H_2} = \dfrac{3}{2}n_{Al} = 0,3(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,3}{2} = 0,15(lít)$
$n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al} = 0,1(mol)$
$C_{M_{Al_2(SO_4)_3}} = \dfrac{0,1}{0,15} = 0,67M$
b)
$V_{H_2} = 0,3.22,4 = 6,72(lít)$
Đúng 2
Bình luận (1)
tính số mol của axit sunfuric có trong 200g dung dịch H2SO4 49%
Ta có mH2SO4=\(\dfrac{49.200}{100}=98g\)
=>nH2SO4=\(\dfrac{98}{2+32+64}=1mol\)
Đúng 0
Bình luận (0)
7.Cho 54 gam Nhôm (Al) phản ứng với dung dịch Axit sunfuric (H2SO4) vừa đủ thì thu được 342 gam muối nhôm sunfat Al2(SO4)3, và 6 gam khí H2. Em hãy: a,Tính khối lượng axit sunfuric (H2SO4) đã dùng b,Tính số mol axit sunfuric (H2SO4) đã phản ứng.6. Cho 96(g) Magiê tác dụng vừa đủ với dung dịch chứa 292(g) Axit clohiđric(HCl) thu được dung dịch Magiê clorua(MgCl2) và thoát ra 8,0 gam khí hiđrô(H2). Em hãy: a,Tính khối lượng Magiê clorua thu được. b,Tính số m...
Đọc tiếp
7.Cho 54 gam Nhôm (Al) phản ứng với dung dịch Axit sunfuric (H2SO4) vừa đủ thì thu được 342 gam muối nhôm sunfat Al2(SO4)3, và 6 gam khí H2. Em hãy:
a,Tính khối lượng axit sunfuric (H2SO4) đã dùng
b,Tính số mol axit sunfuric (H2SO4) đã phản ứng.
6. Cho 96(g) Magiê tác dụng vừa đủ với dung dịch chứa 292(g) Axit clohiđric(HCl) thu được dung dịch Magiê clorua(MgCl2) và thoát ra 8,0 gam khí hiđrô(H2). Em hãy:
a,Tính khối lượng Magiê clorua thu được.
b,Tính số mol Magiê clorua tạo ra.
Cho 2,24 lít khí SO3 (đktc) hòa tan vào nước thu được 500ml dung dịch axit sunfuric(H2SO4)
a) Tính nồng độ mol của dung dịch axit H2SO4.
b)Tính khối lượng Zn có thể phản ứng hết với axit có trong dung dịch trên?
a, PTPƯ: SO3 + H2O ---> H2SO4
nSO3=\(\dfrac{2,24}{22,4}=0,1mol\)
1 mol SO3 ---> 0,1 mol H2SO4
nên 0,1 mol SO3 ---> 0,1 mol H2SO4
CM H2SO4=\(\dfrac{0,1}{0,5}\)=0,2 M
b, PTPƯ: Zn + H2SO4 ---> ZnSO4 + H2
1 mol H2SO4 ---> 1 mol Zn
nên 0,1 mol H2SO4 ---> 0,1 mol Zn
mZn=0,1.65=6,5 g
Đúng 1
Bình luận (0)
Cho 8 gam lưu huỳnh trioxit (
S
O
3
) tác dụng với
H
2
O
, thu được 250 ml dung dịch axit sunfuric (
H
2
S
O
4
). Nồng độ mol của dung dịch axit thu được là A. 0,1M B. 0,4M C. 0,5M D. 0,6M
Đọc tiếp
Cho 8 gam lưu huỳnh trioxit ( S O 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 S O 4 ). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M
Cho 8 gam lưu huỳnh trioxit ( SO 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 SO 4 ).
Xác định nồng độ mol của dung dịch axit thu được.
Nồng độ mol của dung dịch H 2 SO 4 :
n H 2 SO 4 = n SO 3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
C Mdd H 2 SO 4 = 1000x0,1/250 = 0,4M
Đúng 0
Bình luận (0)
1 Tính số mol của H2SO4 trong 100 ml dd H2SO4 49% .
Sau đó tính nồng độ mol của H2SO4
2 Tính nồng độ mol của các dd sau
a 3,65g HCl trong 200 ml dd
b 0.2 mol H2SO4 trong 100 dd
1 thiếu m dd H2SO4 hoặc D nhé
2
\(a\) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5M\)
\(b\) \(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
Đúng 1
Bình luận (1)