một hợp chất chứa Fe và O trong đó O chiếm 42,86% về khối lượng so với Fe Xác định công thức

Những câu hỏi liên quan
Một hợp chất A có 2 nguyên tố, trong đó Fe chiếm 40% về khối lượng còn lại là O . Biết phân tử khối của hợp chất là 160 đvC. Xác định công thức phân tử của A. Giúp mình vs ạ
Gọi CTPT của A là FexOy
Ta có: \(\%Fe=\dfrac{56.x}{160}=40\Rightarrow x=2\)
\(\%O=\dfrac{16.y}{160}=40\Rightarrow y=3\)
Vậy CTPT của A là Fe2O3
Đúng 2
Bình luận (1)
: Phân tích một mẫu hợp chất tạo bởi 2 nguyên tố là Fe và O. Kết quả cho thấy cứ 7 phần khối lượng Fe có tương ứng với 3 phần khối lượng oxi.
a. Viết công thức hóa trị của Fe trong hợp chất
b. Xác định hóa trị của Fe trong hợp chất
Vậy x=2, y=3
Công thức hóa học của hợp chất là 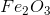
Phân tử khối bằng
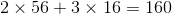
b) Hóa trị của Fe trong hợp chất là : III
Đúng 1
Bình luận (0)
Câu 13 :một hợp chất có thành phần về khối lượng của Fe là 77,78 % còn lại là oxi. Biết PTK gấp 36 lần phân tử hidro .Xác định hóa trị của Fe trong hợp chất và nêu ý nghĩa của công thức đó
(Cho Fe= 56 , Zn=65 Al=27 S=32 , Mg =24 O=16)
Chào em, với dạng bài này là cơ bản lắm nên em phải tự giải được. Anh giúp em 1 lần thôi nha!
\(PTK_{hc}=36.PTK_{H_2}=36.2=72\left(đ.v.C\right)\\ Đặt:Fe_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{77,78\%.72}{56}=1\\ y=\dfrac{72-56.1}{16}=1\\ Với:x=1;y=1\rightarrow CTHH:FeO\)
Còn ý nghĩa em nắm 3 điều sau nha!
- Thứ nhất là hợp chất tạo bởi bao nhiêu nguyên tố, đó là những nguyên tố nào?
-Thứ hai, mỗi nguyên tố có bao nhiêu nguyên tử?
- Thứ ba, phân tử khối của hợp chất là bao nhiêu?
---
Đối với hợp chất FeO, thì công thức hợp chất này có ý nghĩa:
- Hợp chất cấu tạo bởi 2 nguyên tố hóa học là Fe và O.
- Hợp chất bao gồm 1 nguyên tử nguyên tố sắt và 1 nguyên tử nguyên tố Oxi.
- PTKFeO= NTKFe + NTKO= 56+16=72(đ.v.C)
* Hóa trị của Fe trong hợp chất là : II
Có gì không hiểu, em có thể hỏi lại nha ^^
Làm xong các dạng này, em có thể tự mở rộng ra bằng các loại sách nâng cao khác nghen em
Đúng 2
Bình luận (0)
Gọi CTHH của hợp chất là $Fe_xO_y$
Ta có :
$\%Fe = \dfrac{56x}{56x + 16y}.100\% = 77,78\%$
$\Rightarrow x = y$
Mặt khác : $M_{hợp\ chất} = 56x + 16y = 36M_{H_2} = 72$
Suy ra: $x = y = 1$
Vậy CTHH cần tìm là $FeO$
Gọi hóa trị của Fe là a
Theo quy tắc hóa trị, ta có: a.I = II.1 Suy ra a = II
Vậy Fe có hóa trị II trong hợp chất
Ý nghĩa :
- Phân tử được cấu tạo bởi 2 nguyên tố : Sắt và Oxi
- Tỉ lệ số nguyên tử Fe : số nguyên tử O là 1 : 1
- PTK = 72 đvC
Đúng 2
Bình luận (0)
Hợp chất (Y) có công thức FexOy, trong đó Fe chiếm 70% theo khối lượng. Khối lượng phân tử (Y) là 160 amu. Xác định công thức hóa học của hợp chất (Y)
`%O=100%-70%=30%`
`K.L.P.T=56.x+16.y=160 <am``u>`
\(\%Fe=\dfrac{56.x.100}{160}=70\%\)
\(Fe=56.x.100=70\cdot160\)
`56.x.100=11200`
`56.x=11200`\(\div100\)
\(56.x=112\)
`-> x=`\(112\div56=2\)
Vậy, có `2` nguyên tử `Fe` trong phân tử `Fe_xO_y`
\(\%O=\dfrac{16.y.100}{160}=30\%\)
`-> y=3 (` tương tự phần trên `)`
Vậy, có `3` nguyên tử `O` trong phân tử này.
`-> CTHH` của `Y: Fe_2O_3`
Đúng 2
Bình luận (0)
ta có: %O= 100%- %Fe= 100%- 70%= 30%
%Fe = x.56 chia 160 .100%= 70%
x= 2
%O= y.16 chia 160. 100%= 30%
y=3
vậy: CTHH=Fe2O3
Đúng 0
Bình luận (0)
Vật nuôi bị bệnh thường có những dấu hiệu nào? Hãy đề xuất những việc nên làm và không nên làm khi vật nuôi có dấu hiệu bị bệnh.
Đúng 0
Bình luận (0)
Bài 4. Hợp chất A tạo bởi 2 nguyên tố Fe và S. Biết trong A, Fe chiếm 46,67% về khối lượng, khối lượng mol của A bằng 120 g/mol. Xác định công thức hóa học của A.
Số nguyên tử $Fe = \dfrac{120.46,67\%}{56} = 1$
Số nguyên tử $S = \dfrac{120 - 56}{32} = 2$
Vậy CTHH của A là $FeS_2$
Đúng 2
Bình luận (2)
Bài 4. Hợp chất A tạo bởi 2 nguyên tố Fe và S. Biết trong A, Fe chiếm 46,67% về khối lượng, khối lượng mol của A bằng 120 g/mol. Xác định công thức hóa học của A.
Gọi CTHH là $Fe_xS_y$
Ta có :
$\dfrac{56x}{46,67} = \dfrac{32y}{53,33} = \dfrac{120}{100}$
Suy ra : x = 1 ; y = 2
Vậy CTHH của A là $FeS_2$
Đúng 3
Bình luận (0)
Một hợp chất khí B có % theo khối lượng là 42,86%C, 57,14%O. Xác định công thức hóa học của hợp chất biết tỉ khối của B với O2 là 0,875
Xem chi tiết
M(B)= 0,875.M(O2)=0,875.32=28(g/mol)
Gọi CTTQ: CxOy (x,y nguyên dương)
Ta có: %mC/x.M(C) = %mO/y.M(O)
<=> 42,86%/x.12= 57,14%/y.16
=>6,8576y=6,8568x
<=>x/y=6,8576/6,8568=1/1
=>x=y=1 -> B là CO (cacbon oxit)
Đúng 1
Bình luận (0)
1. Oxit cao nhất của R có công thức là RO3 , trong đó nguyên tố O chiếm 60 % về khối lượng . Xác định công thức của R , RO3 , hợp chất khí của R với H. 2.Hợp chất khí với hydro của R có công thức là RH 4 , trong đó nguyên tố H chiếm 25 % về khối lượng . Xác định công thức R , RH4 , oxit cao nhất của R 3.Trong hợp chất khí với hydro RH3 , nguyên tố R chiếm 82,35 % về khối lượng . Xác định công thức R , oxit cao nhất , hợp chất khí của R với H.
Đọc tiếp
1. Oxit cao nhất của R có công thức là RO3 , trong đó nguyên tố O chiếm 60 % về khối lượng . Xác định công thức của R , RO3 , hợp chất khí của R với H. 2.Hợp chất khí với hydro của R có công thức là RH 4 , trong đó nguyên tố H chiếm 25 % về khối lượng . Xác định công thức R , RH4 , oxit cao nhất của R 3.Trong hợp chất khí với hydro RH3 , nguyên tố R chiếm 82,35 % về khối lượng . Xác định công thức R , oxit cao nhất , hợp chất khí của R với H.
Một hợp chất ( muối ngậm nước ) Fe2 ( SO4 )3 . xH2 O, lượng Fe chiếm 19,93% về khối lượng. Xác định giá trị x.
ta có % Fe=19,2%
=> M Fe2(SO4)3.xH2O=\(\frac{56.2}{19.93}.100=562\)g/mol
=> m (SO4)3.xH2O=562-56.2=450g/mol
=> (32+16.4).3+x(18)=450
<=> 18x=450-288=162
=> x=162/18=9
vậy x=9
Đúng 0
Bình luận (1)





















