Tỷ khối của oxi so với không khí; CO so với hidro

Những câu hỏi liên quan
Cho 2,16 gam hỗn hợp gồm Al và Mg tan hết trong dung dịch axit HNO3 loăng, đun nóng nhẹ tạo ra dung dịch X và 448 ml ( đo ở 354,90 K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so với oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi được 3,84 gam chất rắn T. Giá trị của m là A. 15,48 B. 15,18 C. 17,92 D. 16,68.
Đọc tiếp
Cho 2,16 gam hỗn hợp gồm Al và Mg tan hết trong dung dịch axit HNO3 loăng, đun nóng nhẹ tạo ra dung dịch X và 448 ml ( đo ở 354,90 K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so với oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi được 3,84 gam chất rắn T.
Giá trị của m là
A. 15,48
B. 15,18
C. 17,92
D. 16,68.
Theo giả thiết, ta có Y gồm N2 và N2O
Dễ tính được số mol nN2 = nNO2 = 0,01 mol
=> Số mol e để tạo ra 2 khí này là 0,01.10 + 0,01.8 = 0,18 mol (I)
Gọi x và y là số mol của Al và Mg, ta có hệ:
27x + 24y = 2,16 và 102.x/2 + 40y = 3,84
=> x = 0,04, y = 0,045 => số mol e cho là 021 mol (II)
Từ I và II suy ra phải có NH4NO3, từ đây dễ dàng tính được
Hỗn hợp Z gồm: Al(NO3)3 với 8,52gam ; Mg(NO3)2 với 6,66 gam và ; NH4NO3 với 0,3 gam
=> tổng Z = 15,48gam.
=> Đáp án A
Đúng 0
Bình luận (0)
Cho 2,16 gam hỗn họp gồm Al và Mg tan hết trong dung dịch axit HNO3 loãng, đun nóng nhẹ tạo ra dung dịch X và 448 ml (đo ở 354,9°K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so vói oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi thu được 3,84 gam chất rắn T. Giá trị của m là A. 15,18. B. 17,92. C. 16,68. D. 15,48.
Đọc tiếp
Cho 2,16 gam hỗn họp gồm Al và Mg tan hết trong dung dịch axit HNO3 loãng, đun nóng nhẹ tạo ra dung dịch X và 448 ml (đo ở 354,9°K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so vói oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi thu được 3,84 gam chất rắn T. Giá trị của m là
A. 15,18.
B. 17,92.
C. 16,68.
D. 15,48.
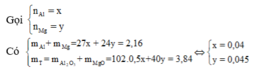
![]()
=> 2 khí đó là N 2 v à N 2 O
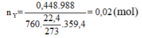
Áp dụng phương pháp đường chéo ta được:
n N 2 = n N 2 O = 0,01 mol
Ta thấy:
![]()
Suy ra phản ứng sinh muối N H 4 N O 3 :
![]()
Áp dụng định luật bảo toàn e, ta có:
![]()
m Z = m A l 2 ( N O 3 ) 3 + m M g ( N O 3 ) 2 + m N H 4 N O 3 = 213.0,04 + 148.0,045 + 80 . 3 , 75 . 10 - 3 = 15 , 48
Đáp án D
Đúng 0
Bình luận (0)
Khí B là đơn chất có công thức A3. Tỷ khối của B so với khí nitơ oxi (NO) là 1,6 . Xác định tên và viết kí hiệu hóa học khí B
\(d_{A/NO}=\dfrac{M_{A_3}}{M_{NO}}=\dfrac{M_{A_3}}{30}=1,6\\ =>M_{A_3}=1,6\cdot30=48\left(g/mol\right)\)
\(=>PTK\left(A_3\right)=48\left(dvC\right)\)
\(=>NTK\left(A\right)=48:3=16\left(dvC\right)\)
=> A là oxi (ki hiệu là O)
=> B là O3
Đúng 1
Bình luận (0)
Một hợp chất A có thành phần phần trăm theo khối kuwowngj của nguyên tố: 50%S; 50%O Biết tỷ khối của A so với khí oxi bằng 2 Tìm CTHH của A
Ta có : dA/O2 = MA/MO2 = MA/32 = 2
=> MA = 32.2 = 64 (g/mol)
mS = 64.50:100 = 32 (g)
mO = 64.50:100 = 32 (g)
=> nS = mS:MS = 32:32 = 1 (mol)
nO = mO:MO = 32:16 = 2 (mol)
Đặt công thức dạng chung của hợp chất A là : SxOy
x = nS = 1
y = nO = 2
Vậy CTHH là : SO2
CHÚC BẠN HỌC TỐT NHA !
Bài nãy mình giải nhầm ! Bài này mới đúng ! Sorry ^^
Đúng 0
Bình luận (0)
Ta có : dA/O2 = MA/MO2 = MA/32 = 2
=> MA = 32.2 = 64 (g/mol)
nS = 32:64.100 = 1 (mol)
nO = 16:64.100 = 2 (mol)
Đặt công thức dạng chung của hợp chất A là : SxOy
x = nS = 1
Y = nO = 2
Vậy CTHH là : SO2
CHÚC BẠN HỌC TỐT NHA !
Đúng 0
Bình luận (0)
1/ Tính tỉ khối của khí oxi so với:
a/ Khí nitơ
b/ Khí clo
2/ Hãy xác định khối lượng mol của khí X biết khí này có tỉ khối so với khí hiđro là 23?
Tính tỉ khối của khí cacbonic, khí amoniac (NH3) so với không khí?
Hỗn hợp X gồm oxi và clo có tỉ khối so với heli là 14. Khối lượng mol trung bình của hỗn hợp khí X tỷ lệ % theo thể tích của O2 trong hỗn hợp X là?
Gọi \(\left\{{}\begin{matrix}n_{Cl_2}=a\left(mol\right)\\n_{O_2}=b\left(mol\right)\end{matrix}\right.\)
Theo đề bài, ta có:
\(\dfrac{71a+32b}{a+b}=14.4=56\left(g\text{/}mol\right)\)
\(\Leftrightarrow\dfrac{a}{b}=\dfrac{8}{5}\\ \Rightarrow\%V_{O_2}=\%n_{O_2}=\dfrac{5}{5+8}.100\%=38,46\%\)
Đúng 2
Bình luận (0)
X có tỷ khối so với hidro là 13. Khối lượng mol của X
Y có tỷ khối so với oxi là 1,375. Khối lượng mol của Y
a. Ta có: dX/H2 = \(\frac{M_X}{M_{H_2}}\)=> MX=dX/H2 . MH2 = 13.2=26 (g)
b. Ta có: dY/O2=\(\frac{M_Y}{M_{O_2}}\)=> MY=dY/O2 . MO2 = 1,375.32=44 (g)
Đúng 0
Bình luận (10)
Oxi hóa hoàn toàn chất hữu cơ A cần vừa đủ 13,44 lít khí CO2 (đktc) thu được 19,8 gam CO2 và 5,4 gam nước. Biết tỷ khối của A so với khí He bằng 10. Công thức phân tử của A là ?
\(n_{CO_2}=\dfrac{19,8}{44}=0,45\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toán C: nC(A) = 0,45 (mol)
Bảo toàn H: n(H(A) = 2.0,3 = 0,6 (mol)
Bảo toán O: nO(A) + 2.nO2 = 2.nCO2 + nH2O
=> nO(A) = 2.0,45 + 0,3 - 0,6.2 = 0
nC : nH = 0,45 : 0,6 = 3:4
=> CTPT: (C3H4)n
Mà M = 10.4 = 40(g/mol)
=> n = 1 => CTPT: C3H4
Đúng 4
Bình luận (0)
Tính tỉ khối của oxi, cacbonic, hiđro so với không khí
\(d_{O_2/kk}=\dfrac{M_{O_2}}{M_{kk}}=\dfrac{32}{29}\approx1,1\\ d_{Co_2/kk}=\dfrac{M_{CO_2}}{M_{kk}}=\dfrac{44}{29}\approx1,5\\ d_{H_2/kk}=\dfrac{M_{H_2}}{M_{kk}}=\dfrac{2}{29}\approx0,07\)
Đúng 3
Bình luận (0)
dO/kk=16/29=0,5 g/mol
dCO2/kk=44/291,5 g/mol
dH/kk=1/29=0,03 g/mol
Đúng 0
Bình luận (0)


















