Đốt cháy hoàn toàn 1 g nguyên tố R cần 0,7 lít õi(đktc) ,thu được hợp chất X Tìm công thức
đốt cháy hoàn toàn 1g nguyên tố R, cần 0,7 l oxi(dktc) thu đc hợp chất X. tìm công thức R,X
Gọi hóa trị của R là n
\(n_{O_2}=\dfrac{0,7}{22,4}=0,03125\left(mol\right)\)
\(4R+nO_2\rightarrow\left(t^o\right)2R_2O_n\)
\(\dfrac{0,125}{n}\) 0,03125 ( mol )
\(M_R=\dfrac{1}{\dfrac{0,125}{n}}=8n\)
Chỉ có `n=4` thỏa mãn `->` R là Lưu huỳnh ( S ) `->` X là `SO_2`
Câu 5 (4,0 điểm). Y là hợp chất chứa 3 nguyên tố C, H, O. Trộn 1,344 lít CH4 với 2,688 lít khí Y thu được 4,56 g hỗn hợp khí Z. Đốt cháy hoàn toàn Z thu được 4,032 lít CO2 (các khí đo ở đktc). 1) Tính khối lượng mol của Y. 2) Xác định công thức phân tử Y
1. Ta có: \(n_{CH_4}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(n_Y=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
⇒ 0,06.16 + 0,12.MY = 4,56 ⇒ MY = 30 (g/mol)
2. Gọi CTPT của Y là CxHyOz.
Ta có: \(n_{CO_2}=\dfrac{4,032}{22,4}=0,18\left(mol\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_xH_yO_z+\left(\dfrac{2x+\dfrac{y}{2}-z}{2}\right)O_2\underrightarrow{t^o}xCO_2+\dfrac{y}{2}H_2O\)
Theo PT: \(n_{CO_2}=n_{CH_4}+xn_{C_xH_yO_z}\Rightarrow0,18=0,06+0,12x\)
\(\Rightarrow x=1\)
→ CTPT của Y có dạng CHyOz
Mà: MY = 30 (g/mol)
⇒ 12 + y + 16z = 30
⇒ y + 16z = 18
Với z = 1 ⇒ y = 2 (nhận)
z = 2 ⇒ y = -14 (loại)
Vậy: CTPT của Y là CH2O.
Đốt cháy hoàn toàn một hợp chất hữu cơ A chứa các nguyên tố C, H, N thu được 13,44 lít CO2 (đktc); 16,2 gam nước và 2,24 lít khí nitơ (đktc). Tỉ khối của A so với He ( MHe = 4) là 14,75. Tìm công thức phân tử của A. (ĐA: C3H9N)
\(n_{CO_2}=0,6\left(mol\right);n_{H_2O}=0,9\left(mol\right);n_{N_2}=0,1\left(mol\right)\\ TrongA:n_C=n_{CO_2}=0,6\left(mol\right)\\ n_H=2n_{H_2O}=1,8\left(mol\right)\\ n_N=2n_{N_2}=0,2\left(mol\right)\\ CTPT:C_xH_yN_t\\ Tacó:x:y:t=0,6:1,8:0,2=3:9:1\\ \Rightarrow CTTQ:\left(C_3H_9N\right)_n\\ Tacó:d_{A/He}=14,75\Rightarrow M_A=14,75.4=59\\ \Rightarrow\left(12.3+9+14\right)n=56\\ \Rightarrow n=1\\ VậyCTPTcủaA:C_3H_9N\)
Đốt cháy hoàn toàn 5,8g một hợp chất hữu cơ X bằng khí \(O_2\), thu được 6,72 lít khí \(CO_2\) (ở đktc), và 5,4g \(H_2O\). Xác định công thức phân tử và thành phần phần trăm khối lượng của các nguyên tố trong X?
Giúp mk vs ạ mình đang cần gấp thanks trước
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ n_{H_2O}=\dfrac{5,4}{18}=0,3(mol)\)
Bảo toàn C và H: \(n_C=0,3(mol);n_H=0,6(mol)\)
\(\Rightarrow m_C=0,3.12=3,6(g);m_H=0,6.1=0,6(g)\\ \Rightarrow m_X>m_C+m_H\)
Do đó X bao gồm \(O\)
\(\Rightarrow m_O=5,8-3,6-0,6=1,6(g)\\ \Rightarrow n_O=\dfrac{1,6}{16}=0,1(mol)\)
Gọi CT của X là \(C_xH_yO_z\)
\(\Rightarrow x:y:z=0,3:0,6:0,1=3:6:1\\ \Rightarrow CTPT_X:C_3H_6O\)
\(\%_C=\dfrac{36}{58}.100\%=62,07\%\\ \%_H=\dfrac{6}{58}.100\%=10,34\%\\ \%_O=100\%-62,07\%-10,34\%=27,59\%\)
Làm tiếp của Nguyễn Hoàng Minh
Gọi CTHH của X là: \(C_xH_yO_z\)
Ta có: \(m_{C_X}=m_{C_{CO_2}}=0,3.12=3,6\left(g\right)\)
\(m_{H_X}=m_{H_{H_2O}}=0,3.2=0,6\left(g\right)\)
\(m_{O_X}=m_{O_{CO_2}}+m_{O_{H_2O}}-m_{O_2}=9,6+4,8-12,8=1,6\left(g\right)\)
\(\Rightarrow\%_O=\dfrac{1,6}{5,8}.100\%=27,6\%\)
\(\%_H=\dfrac{0,6}{5,8}.100\%=10,3\%\)
\(\%_C=100\%-27,6\%-10,3\%=62,1\%\)
Đốt cháy hoàn toàn một hợp chất X, cần dùng hết 10,08 lít O2 (đktc). Sau phản ứng, chỉ thu được 13,2 gam khí CO2 và 7,2 gam nước.
a/ Tính khối lượng chất X đã phản ứng.
b/ Tìm công thức hoá học của X (biết công thức dạng đơn giản chính là công thức hoá học của X).
c/ Viết phương trình hoá học đốt cháy chất X ở trên.
\(n_C=\dfrac{13,2}{44}=0,3\left(mol\right)\\ n_H=2.\dfrac{7,2}{18}=0,8\left(mol\right)\\ n_O=2.\dfrac{13,2}{44}+\dfrac{7,2}{18}-\dfrac{10,08}{22,4}=0,1\left(mol\right)\\ m_X=0,3.12+0,8+0,1.16=6\left(g\right)\\ CTPT:C_xH_yO_z\\ \Rightarrow x:y:z=0,3:0,8:0,1=3:8:1\)
Mà CTHH của X là CTDGN
=> CTHH của X: C3H8O
PTHHH: 2C3H8O + 9O2 ---to---> 6CO2 + 8H2O
Đốt cháy hoàn toàn hợp chất hữu cơ X (chứa các nguyên tố C, H, O) thu được khí CO2 và hơi H2Otheo tỉ lệ thể tích 6 : 5 (đo ở cùng điều kiện nhiệt độ, áp suất).
a) Tìm công thức phân tử của X, biết tỉ khối hơi của X so với He bằng 36,5.
b) Để đốt cháy hoàn toàn p gam X cần 7,28 lít O2 (đktc). Tính p
c) Cho 14,6 gam X phản ứng hoàn toàn với dung dịch KOH thì thu được muối của một axit cacboxylic và 9,2 gam ancol.
+ Xác định công thức cấu tạo có thể có của X
+ Trong số các công thức cấu tạo của X ở trên, công thức nào phù hợp với điều kiện sau: lấy 9,2 gam ancol ở trên cho tác dụng với Na dư sau phản ứng khí thoát ra vượt quá 3,0 lít (đktc).
a) MX = 146g/mol
VCO2 : VH2O = 6 : 5
=> nC : nH = 3 : 5
=> CTĐGN: (C3H5Oa)n
→ (41 + 16a).n = 146 → (a; n) = (4; 2) → X: C6H10O4
b) C6H10O4 + 6,5O2 → 6CO2 + 5H2O
0,05 0,325
=> p = 7,3g
c)
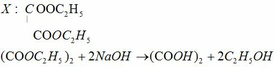
Đốt cháy hoàn toàn 9(g) hợp chất hữu cơ X thu được 5,04(g) H2 0 và 6,72(l) khí (đktc) lm đục nc vôi trg
a, hợp chất hữu cơ chứa những nguyên tố nào
b,xác định công thức phân tử của hợp chất hữu cơ trên biết phân tử khối X là 180
Sửa đề: 5,04 gam -> 5,4 gam
a)
Theo ĐLBTNT: \(\left\{{}\begin{matrix}n_H=2n_{H_2O}=2.\dfrac{5,4}{18}=0,6\left(mol\right)\\n_C=n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\n_O=\dfrac{9-0,3.12-0,6}{16}=0,3\left(mol\right)\end{matrix}\right.\)
Vậy X chứa C, H, O
b) Đặt CTPT của X là CxHyOz
\(\Rightarrow n_X=\dfrac{9}{180}=0,05\left(mol\right)\Rightarrow\left\{{}\begin{matrix}x=\dfrac{0,3}{0,06}=6\\y=\dfrac{0,6}{0,05}=12\\z=\dfrac{0,3}{0,05}=6\end{matrix}\right.\)
Vậy X là C6H12O6
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và
10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của X
Câu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.
Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X
Câu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 40% ; %mH = 6,67% còn lại là oxi.
Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Câu 7:
\(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\)
Bảo toàn C: nC = 0,6 (mol)
Bảo toàn H: nH = 1,2 (mol)
=> \(n_O=\dfrac{10,8-0,6.12-1,2}{16}=0,15\left(mol\right)\)
=> nC : nH : nO = 0,6 : 1,2 : 0,15 = 4:8:1
=> CTPT: (C4H8O)n
Mà M = 2,25.32 = 72(g/mol)
=> n = 1
=> CTPT: C4H8O
Câu 6
\(n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn C: nC = 0,25 (mol)
Bảo toàn H: nH = 0,6 (mol)
=> \(n_O=\dfrac{4,4-0,25.12-0,6.1}{16}=0,05\left(mol\right)\)
nC : nH : nO = 0,25 : 0,6 : 0,05 = 5:12:1
=> CTPT: (C5H12O)n
Mà M = 44.2=88(g/mol)
=> n = 1
=> CTPT: C5H12O
Câu 8:
MX = 1,875.32 = 60 (g/mol)
Giả sử có 1 mol chất X => mX = 60.1 = 60 (g)
\(m_C=\dfrac{60.40}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{60.6,67}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
\(m_O=60-24-4=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> Trong 1 mol X chứa 2 mol C, 4 mol H, 2 mol O
=> CTPT: C2H4O2
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và
10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của X
Câu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.
Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X
Câu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 40% ; %mH = 6,67% còn lại là oxi.
Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X