Ngâm 1 lá Cu có khối lượng 10g trong 250g đe AgNO3 4%. Khi pư kết thúc lấy lá Cu ra thấy khối lượng giảm 17%. Xđ khối luongj Cu sau pư

Những câu hỏi liên quan
Cho một lá đồng có khối lượng 5g vào 125g dung dịch AgNO3 4%. Sau một thời gian khi lấy lá đồng ra thì khối lượng AgNO3 trong dung dịch giảm 17%. Xác định khối lượng kim loại Cu sau phản ứng.
Ngâm một vật bằng đồng có khối lượng 12g trong 250g dung dịch AgNO3 4% . Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17% . Khối lượng của vật sau phản ứng là (Cu = 64, Ag = 108, N = 14, O = 16)
A. 12,76 gam.
B. 10,76 gam.
C. 12,67 gam.
D. 10,67 gam.
\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A
Đúng 1
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4% khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%. Xác định khối lượng của vật sau phản ứng.
Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g
Đúng 0
Bình luận (0)
ngâm 1 lá Cu vào dd AgNO3 sau phản ứng khối lượng lá Cu tăng 1,52. Tính khối lượng Cu và AgNO3
PTHH : Cu + 2AgNO3 → Cu(NO3) + 2Ag
Gọi số mol Cu phản ứng là x => nAg = 2x
Khối lượng lá Cu tăng = mAg (bám vào) = mCu phản ứng tan ra = 2x.108 - 64x=1,52
=> x =0,01 mol
=> mCu phản ứng = 0,01.64 = 0,64 gam , mAgNO3 phản ứng = 0,02.170= 3,4 gam
Đúng 1
Bình luận (0)
Ngâm viên bi bằng sắt có khối lượng 45g trong 20ml dd Cu(NO3)2 0,3M. Kết thúc pư khối lượng viên bi (sau khi đã rửa nhẹ làm khô) nặng bao nhiêu gam
Xem chi tiết
( Không chắc nhé :)))
\(n_{Cu\left(NO_3\right)_2}=0,02.0,3=0,006\left(mol\right)\)
\(PTHH:Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\)
\(\left(mol\right)\) `0,006` `0,006` `0,006`
\(\Delta m\uparrow=0,006.64-0,006.56=0,048\left(g\right)\)
\(m_{vb}=45+0,048=45,048\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 29: Ngâm 1 lá đồng trong dd AgNO3, sau khi phản ứng kết thúc, lấy lá đồng ra khỏi dd, rửa nhẹ, làm khô thấy khối lượng lá đồng tăng 1,52g. Khối lượng đồng tham gia phản ứng là
Gọi : \(n_{Cu\ pư} = a(mol)\)
\(Cu + 2AgNO_3 \to 2Ag + Cu(NO_3)_2\\ n_{Ag} = 2n_{Cu} = 2a(mol)\\ \Rightarrow 2a.108 - 64a = 1,52\\ \Rightarrow a = 0,01(mol)\\ m_{Cu\ pư} = 0,01.64 = 0,64(gam)\)
Đúng 1
Bình luận (0)
Ngâm 1 vật bằng Cu có khối lượng là 5 g vào 250 g AgNO3 4%, khi nhấc vật ra khỏi dd thì lương AgNO3 trong dd giảm đi 17%. Khối lượng của vật sau phản ứng?
\(m_{Cu\left(pư\right)}=a\left(g\right)\\ Cu+2AgNO_3->Cu\left(NO_3\right)_2+2Ag\\ m_{AgNO_3\left(pư\right)}=0,17.0,04.250:108=\dfrac{a}{64}\\ a=1\left(g\right)\\ m_{vật}=5-1+\dfrac{2}{64}.108=7,375g\)
Đúng 2
Bình luận (0)
Ngâm một vật bằng Cu có khối lượng 15g trong 340g dung dịch AgNO3 6%. Sau một thời gian lấy vật ra thấy khối lượng AgNO3 trong dung dịch giảm 25%. Khối lượng của vật sau phản ứng là
A. 15,26 g
B. 17,28 g
C. 16,15 g
D. 18,16g
Khối lượng của AgNOg trong dung dịch là:
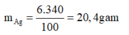
Phương trình phản ứng xảy ra:
![]()
Cứ 1 mol Cu phản ứng với 2 mol AgNO3, sinh ra 1 mol Cu(NO3)2 và 2 mol Ag, khối lượng kim loại tăng
![]()
Khối lượng AgNO3 đã tham gia phản ứng:
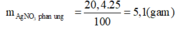
Từ (1)=> Số mol Cu đã phản ứng:
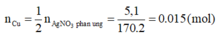
=> Khối lượng của vật sau phản ứng: m = 15 + 152.0,015 = 17,28 (gam).
Đáp án B.
Đúng 0
Bình luận (0)
Ngâm một lá sắt trong dung dịch CuSO4 , sau một thời gian lấy lá sắt ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng lá sắt tăng thêm 2g. Tính khối lượng Fe bị hòa tan và khối lượng Cu bám trên lá sắt.
\(Fe+CuSO_4\to FeSO_4+Cu\)
Đặt \(n_{CuSO_4}=x(mol)\)
\(\Rightarrow 64x-56x=2\\ \Rightarrow x=0,25(mol)\\ \Rightarrow n_{Fe}=n_{Cu}=0,25(mol)\\ \Rightarrow m_{Fe}=0,25.56=14(g);m_{Cu}=0,25.64=16(g)\)
Đúng 2
Bình luận (0)




















