Hoà tan hoàn toàn 2,4g kim loại M vào dd HNO3 lấy dư thu được 0,448 lít khí N2 (đktc). Tìm M?
Hoà tan hoàn toàn 1,2 gam kim loại M vào dung dịch HNO3 dư thu được 0,224 lít khí N2 (sản phẩm khử duy nhất) ở (đktc). Kim loại M là:
A. Mg.
B. Fe.
C. Al.
D. Cu.
Đáp án A:
Các quá trình nhường và nhận electron:
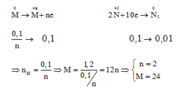
Hoà tan hết 2,4g kim loại M bằng dung dịch HNO3 dư được 0,448lít khí N2 là sản phẩm khử duy nhất đktc . Tìm M :
A. Zn
B. Mg
C. Al
D. Ca
nN2 = 0,02
Nhận e: 2N+5 + 10e → N2
0,2 ← 0,1 (mol)
Nhường e:
M → M+n + ne
0,2/n ← 0,2 (mol) (Bảo toàn e)
⇒ mM = M.0,2/n = 2,4 ⇒ M = 12n
⇒ n = 2 và M = 24 (Mg)
Đáp án B.
Hoà tan hoà toàn m gam kim loại M bằng dd HCl dư, thu được muối MCln và V lít H2 (đktc). Mặt khác hoà tan hoàn toàn m gam M bằng dd HNO3 loãng, thu được muối M(NO3)m, H2O và cũng V lít khí NO duy nhất (đktc).
a/ So sánh n và m.
b/ Hỏi M là kim loại nào? Biết rằng khối lượng muối nitrat tạo thành gấp 1,905 lần khối lượng muối clorua.
a)Gọi hóa trị của M trong muối clorua là n
Gọi hóa trị của M trong muối nitrat là m
2M + 2nHCl -----> 2MCln + nH2
_1___________________n/2_
3M + 4mHNO3 -----> 3M(NO3)m + mNO + 2mH2O
_1_________________________m/3_
Ta có: VH2 = VNO => nH2 = nNO
m/3 = n/2 --> n/m = 2/3 => n = 2; m = 3
Vậy hóa trị của M trong muối clorua < hóa trị của M trong muối nitrat
b,
mM(NO3)m = 1,905m.MCln
M + 62m = 1,905x(M + 35,5n)
<=> 0,905M + 67,6275n = 62m
<=> M = (62m - 67,6275n)/0,905
Thay n = 2; m = 3 vào ta được
M = 56 (Fe)
Kim loại M có hóa trị n và m (n; m = 1; 2 hoặc 3). Hoà tan hoà toàn a gam M bằng dd HCl dư, thu được muối MCln và V lít H2 (đktc). Mặt khác hoà tan hoàn toàn a gam M bằng dd HNO3 loãng, thu được muối M(NO3)m, H2O và cũng V lít khí NO duy nhất (đktc).
a/ Viết PTHH của 2 phản ứng trên.
b/ So sánh n và m.
c/ Hỏi M là kim loại nào? Biết rằng khối lượng muối nitrat tạo thành gấp 1,905 lần khối lượng muối clorua.
a)Gọi hóa trị của M trong muối clorua là n
Gọi hóa trị của M trong muối nitrat là m
2M + 2nHCl -----> 2MCln + nH2
_1___________________\(\dfrac{n}{2}\)
3M + 4mHNO3 -----> 3M(NO3)m + mNO + 2mH2O
_1_________________________\(\dfrac{m}{3}\)_
Ta có: VH2 = VNO => nH2 = nNO
\(\dfrac{m}{3}=\dfrac{n}{2}\) --> \(\dfrac{n}{m}=\dfrac{2}{3}\) => n = 2; m = 3
Vậy hóa trị của M trong muối clorua < hóa trị của M trong muối nitrat
b,
mM(NO3)m = 1,905m.MCln
M + 62m = 1,905x(M + 35,5n)
<=> 0,905M + 67,6275n = 62m
<=> M = \(\dfrac{62m-67,6275n}{0,905}\)
Thay n = 2; m = 3 vào ta được
M = 56 (Fe)
a)
2M + 2nHCl --> 2MCln + nH2
3M + 4mHNO3 --> 3M(NO3)m + mNO + 2mH2O
b)
\(n_M=\dfrac{a}{M_M}\left(mol\right)\)
PTHH: 2M + 2nHCl --> 2MCln + nH2
\(\dfrac{a}{M_M}\)--------------------->\(\dfrac{an}{2.M_M}\)
3M + 4mHNO3 --> 3M(NO3)m + mNO + 2mH2O
\(\dfrac{a}{M_M}\)-------------------------->\(\dfrac{am}{3.M_M}\)
=> \(\dfrac{an}{2.M_M}=\dfrac{am}{3.M_M}\)
=> \(\dfrac{n}{m}=\dfrac{2}{3}< 1\)
=> n < m
c)
Có: n = 2; m = 3
Giả sử số mol M là k (mol)PTHH: M + 2HCl --> MCl2 + H2 k------------->k M + 4HNO3 --> M(NO3)3 + NO + 2H2O k------------------>k=> \(\left\{{}\begin{matrix}m_{MCl_2}=k\left(M_M+71\right)\left(g\right)\\m_{M\left(NO_3\right)_3}=k\left(M_M+186\right)\left(g\right)\end{matrix}\right.\)=> \(\dfrac{M_M+186}{M_M+71}=1,905\)=> MM = 56 (g/mol)=> M là FeKim loại M có hóa trị n và m (n; m = 1; 2 hoặc 3). Hoà tan hoà toàn a gam M bằng dd HCl dư, thu được muối MCln và V lít H2 (đktc). Mặt khác hoà tan hoàn toàn a gam M bằng dd HNO3 loãng, thu được muối M(NO3)m, H2O và cũng V lít khí NO duy nhất (đktc).
a/ Viết PTHH của 2 phản ứng trên.
b/ So sánh n và m.
c/ Hỏi M là kim loại nào? Biết rằng khối lượng muối nitrat tạo thành gấp 1,905 lần khối lượng muối clorua.
a)
2M + 2nHCl --> 2MCln + nH2
3M + 4mHNO3 --> 3M(NO3)m + mNO + 2mH2O
b)
\(n_M=\dfrac{a}{M_M}\left(mol\right)\)
PTHH: 2M + 2nHCl --> 2MCln + nH2
\(\dfrac{a}{M_M}\)------------------->\(\dfrac{an}{2.M_M}\)
3M + 4mHNO3 --> 3M(NO3)m + mNO + 2mH2O
\(\dfrac{a}{M_M}\)---------------------------->\(\dfrac{am}{3.M_M}\)
=> \(\dfrac{an}{2.M_M}=\dfrac{am}{3.M_M}\)
=> \(\dfrac{n}{m}=\dfrac{2}{3}\)
=> n < m
c) Chọn n = 2; m = 3
PTHH: M + 2HCl --> MCl2 + H2
\(\dfrac{a}{M_M}\)--------->\(\dfrac{a}{M_M}\)
M + 4HNO3 --> M(NO3)3 + NO + 2H2O
\(\dfrac{a}{M_M}\)----------->\(\dfrac{a}{M_M}\)
=> \(\left\{{}\begin{matrix}m_{MCl_2}=\dfrac{a}{M_M}\left(M_M+71\right)\\m_{M\left(NO_3\right)_3}=\dfrac{a}{M_M}\left(M_M+186\right)\end{matrix}\right.\)
=> \(\dfrac{M_M+186}{M_M+71}=1,905\)
=> MM = 56 (g/mol)
=> M là Fe
Hòa tan hoàn toàn 7,15 gam kim loại M vào lượng dư dung dịch HNO3 loãng, thu được 0,448 lít (đktc) hỗn hợp 2 khí không màu, không hóa nâu trong không khí và dung dịch chứa 21,19 gam muối. Kim loại M là
A. Fe
B. Al
C. Ag
D. Zn
Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.
- Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí H 2 (đktc).
- Cho phần 2 vào một lượng dư H 2 O , thu được 0,448 lít khí H 2 (đktc) và m gam hỗn hợp kim loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H 2 (đktc). Tính khối lượng mỗi kim loại trong mỗi phần.
Hòa tan hoàn toàn 7,15 gam kim loại M hóa trị 2 vào lượng dư dung dịch HNO3 loãng, thu được 0,448 lít(đktc) hỗn hợp 2 khí không màu, không hóa nâu trong không khí (số mol hai khí bằng nhau) và dung dịch chứa 21,19 gam muối. Kim loại M là:
A. Fe
B. Ca
C. Mg
D. Zn
2 khí không màu, không hóa nâu trong không khí và là sản phẩm khử của N+5 chỉ có thể là N2 và N2O
-TH1: 21,19 gam muối không có muối NH4NO3
Theo bảo toàn nguyên tố M ta có: nM= nM(NO3)2
→ m M m M ( N O 3 ) 2 = M M M M ( N O 3 ) 2 → 7 , 15 21 , 19 = M M + 62 , 2
→M= 63,148 Loại
Do đó trường hợp này loại
-TH2: 21,19 gam muối có muối NH4NO3
QT cho e:
M → M2++ ne (1)
7,15/M 7,15.2/M
QT nhận e : nkhí= 0,02 mol. Mà số mol hai khí bằng nhau nên n N 2 O = n N 2 =0,01mol
2NO3-+ 8e+ 10H+ → N2O + 5H2O (2)
0,08 0,1 ← 0,01 mol
2NO3-+ 10e+12H+→ N2+ 6H2O (3)
0,1 0,12← 0,01 mol
NO3-+ 8e + 10H+ → NH4+ + 3H2O (4)
8x xmol
Đặt số mol muối NH4+ là x mol
Theo ĐL BT e: ne cho= ne nhận nên 7,15.2/M= 0,08 + 0,1+8x (*1)
Mặt khác : mmuối= mM(NO3)2+ mNH4NO3= 7,15/M. (M+124)+80x= 21,19 (*2)
Từ (*1) và (*2) ta có: x= 5.10-3 và M=65. M là Zn
Đáp án D
Hoà tan hoàn toàn kim loại A vào dd HNO3 loãng thu được dd X và 0,2 mol NO (sp khử duy nhất). Tương tự cũng hoà tan hoàn toàn kim loại B vào dd HNO3 trên chỉ thu được dd Y. trộn X với Y thu được dd Z. Trộn X với Y thu được dd Z. cho NaOH dư vào Z thu được 0,1 mol khí và một kết tủa D. Nung D đến khối lượng không đổi được 40 g chất rắn. Biện luận để tìm khối lượng nguyên tử của A,B. Biết rằng A, B có hoá trị II, tỉ lệ khối lượng nguyên tử của chúng là 3:8 và khối lượng nguyên tử của chúng đều là số nguyên lớn hơn 23 và nhỏ hơn 70.
Giải
mình thấy trên mạng giải thế này :
nNO=0,2=> nA=0,3
nNH3= 0,1=>nB=0,4
Các bạn giải thích giúp mình tại sao từ nNO=0,2 thì lại được nA=0,3