Hòa tan hoàn toàn m gam hỗn hợp NaO,Al2O3 vào nước dk dd trong suốt A. Thêm dần dần dd HCl 1M vào dd A nhận thấy khi bắt đầu xuốt hiện kết tủa thì thể tích dd HCl 1M đã cho vào là 100 ml còn khi cho vào 200 ml hoặc 600 ml dd HCl 1M thì đều thu được a gam kết tủa. tính a và m?

Những câu hỏi liên quan
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X. Thêm dần dần dung dịch HCl 1M vào dung dịch X nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100 ml còn khi cho vào 200 ml hoặc 600 ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là A. 7,8 và 19,5 B. 15,6 và 19,5 C. 7,8 và 39 D. 15,6 và 27,7
Đọc tiếp
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X. Thêm dần dần dung dịch HCl 1M vào dung dịch X nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100 ml còn khi cho vào 200 ml hoặc 600 ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
A. 7,8 và 19,5
B. 15,6 và 19,5
C. 7,8 và 39
D. 15,6 và 27,7
Hoà tan hoàn toàn hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X (NaOH dư,NaAlO2)
Chú ý thứ tự các phản ứng khi thêm dung dịch HCl vào dung dịch X
HCl + NaOH → NaCl + H2O (1)
NaAlO2+ HCl+ H2O → NaCl + Al(OH)3 (2)
Al(OH)3 + 3HCl → AlCl3 + 3H2O (3)
Khi thêm 0,1 mol HCl thì bắt đầu xuất hiện kết tủa → nNaOH dư = 0,1 mol (xảy ra (1))
Khi thêm 0,2 mol HCl thì xảy ra (1), (2) ( lượng AlO2- trong pt (2)dư )
→ nkết tủa = nH+ phản ứng (2) = 0,2 - 0,1 = 0,1 mol → a = 7,8 gam. Loại B,D
Khi thêm 0,6 mol HCl xảy ra hiện tượng hòa tan kết tủa (xảy ra cả 3 phương trình)
→ 4×nAlO2- = 3nkết tủa + (nH+ -0,1) → nAlO2- = 0,2 mol
Vậy NaAlO2 0,2 mol, NaOH dư 0,1 mol → m= mAl2O3 + mNa2O = 0,1×102 + 0,15×62 = 19,5 gam
Đáp án A
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt A. Thêm dần dần dung dịch HCl 1M vào dung dịch A nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100ml còn khi cho vào 200ml hoặc 600ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Tính a và m. A. a 7,8g; m 19,5g B. a 15,6g; m 19,5 C. a 7,8g; m 39g D. a 15,6g; m 27,7g
Đọc tiếp
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt A. Thêm dần dần dung dịch HCl 1M vào dung dịch A nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100ml còn khi cho vào 200ml hoặc 600ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Tính a và m.
A. a = 7,8g; m = 19,5g
B. a = 15,6g; m = 19,5
a = 7,8g; m = 39g
D. a = 15,6g; m = 27,7g
Đáp án A
Khi cho hỗn họp gồm Na2O và A12O3 có phản ứng:
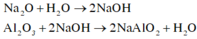
Vì sau một thời gian cho HCl vào dung dịch A mới xuất hiện kết tủa nên A gồm NaA1O2 và NaOH dư
Thứ tự các phản ứng xảy ra:
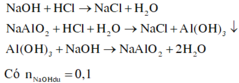
Vì khi cho 200ml hoặc 600ml dung dịch HCl 1M đều thu được a gam kết tủa nên khi cho 200ml dung dịch HCl thì chưa có sự hòa tan kết tủa và khi cho 600ml dung dịch HCl thì đã có sự hòa tan kết tủa.
Do đó:
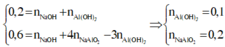
Áp dụng định luật bảo toàn nguyên tố cho Al và Na có
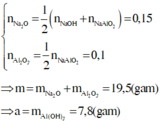
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt A. Thêm dần dần dung dịch HCl 1M vào dung dịch A nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100ml còn khi cho vào 200ml hoặc 600ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Tính m A. 17,64 B. 16,24 C. 20,48 D. 22,24
Đọc tiếp
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt A. Thêm dần dần dung dịch HCl 1M vào dung dịch A nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100ml còn khi cho vào 200ml hoặc 600ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Tính m
A. 17,64
B. 16,24
C. 20,48
D. 22,24
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X. Thêm dần dần dung dịch HCl 1M vào dung dịch X nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100ml còn khi cho vào 200ml hoặc 600ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là A. a 7,8 ; m 19,5 B. a 15,6 ; m 19,5 C. a 7,8 ; m 39 D. a 15,6 ; m 27,7
Đọc tiếp
Hoà tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X. Thêm dần dần dung dịch HCl 1M vào dung dịch X nhận thấy khi bắt đầu thấy xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100ml còn khi cho vào 200ml hoặc 600ml dung dịch HCl 1M thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
A. a = 7,8 ; m = 19,5
B. a = 15,6 ; m = 19,5
C. a = 7,8 ; m = 39
D. a = 15,6 ; m = 27,7
Bắt đầu xuất hiện kết tủa n H C l = n N a O H ( d u ) = 0 , 1 S ố m o l H C l s a u k h i p h ả n ứ n g v ớ i N a O H n H C l ( 1 ) = 0 , 2 - 0 , 1 = 0 , 1 ; n H C l ( 2 ) = 0 , 6 - 0 , 1 = 0 , 5
Do khi cho vào 200ml hoặc 600ml HCl thì đều thu được cùng một lượng kết tủa nên ở TN1 kết tủa chưa tan, ở TN2 kết
tủa tan 1 phần
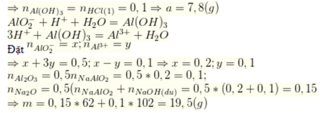
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X. Thêm từ từ dung dịch HCl 1M vào dung dịch X nhận thấy khi bắt đầu xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100 ml. Còn khi cho 250 ml hoặc 650 ml dung dịch HCl 1M vào dung dịch X thì sẽ thu được lượng kết tủa như nhau. Giá trị m là A. 20,5 B. 23,6 C. 19,5 D. 39,0
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X. Thêm từ từ dung dịch HCl 1M vào dung dịch X nhận thấy khi bắt đầu xuất hiện kết tủa thì thể tích dung dịch HCl 1M đã cho vào là 100 ml. Còn khi cho 250 ml hoặc 650 ml dung dịch HCl 1M vào dung dịch X thì sẽ thu được lượng kết tủa như nhau. Giá trị m là
A. 20,5
B. 23,6
C. 19,5
D. 39,0
Gọi số mol của Na2O là x, Al2O3 là y mol
Nhận thấy khi thêm 0,1 mol HCl mới bắt đầu tạo kết tủa → Trong dung dịch X chứa NaAlO2 và NaOH dư → nNaOH dư = 0,1 mol
Khi thêm 0,25 mol hoặc 0,65 mol HCl thì lượng kết tủa như nhau → khi thêm 0,25 mol HCl thì lượng HCl hết lượng NaAlO2 còn dư
→ nHCl = nNaOH dư + nAl(OH)3 → 0,25 = 0,1 + nAl(OH)3 → nAl(OH)3 = 0,15 mol
Khi thêm 0,65 mol thì HCl và NaAlO2 đều hết
→ 4nNaAlO2 = (nHCl -nNaOH dư)+ 3nAl(OH)3 → 8y = (0,65-0,1) + 3.0,15 → y = 0,125 mol
Bảo toàn nguyên tố Na → nNa2O = (nNaOH dư + nNaAlO2) :2 = (0,1 + 0,25 ):2 = 0,175mol
→ m= 0,125.102 +0,175.62 = 23,6 gam.
Đáp án B
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 19,5 gam hỗn hợp Na2O, Al2O3 vào nước được 500ml dung dịch trong suốt X. Thêm dần dần dung dịch HCl 1M vào dung dịch X đến khi bắt đầu thấy xuất hiện kết tủa thì dừng lại nhận thấy thể tích dung dịch HCl 1M đã cho vào là 100ml. Tính nồng độ mol của các chất tan trong dung dịch A. [Na[Al(OH)4]] 0,2M; [NaOH] 0,4M B. [Na[Al(OH)4]] 0,2M; [NaOH] 0,2M C. [Na[Al(OH)4]] 0,4M; [NaOH] 0,2M D. [Na[Al(OH)4]] 0,2M
Đọc tiếp
Hoà tan hoàn toàn 19,5 gam hỗn hợp Na2O, Al2O3 vào nước được 500ml dung dịch trong suốt X. Thêm dần dần dung dịch HCl 1M vào dung dịch X đến khi bắt đầu thấy xuất hiện kết tủa thì dừng lại nhận thấy thể tích dung dịch HCl 1M đã cho vào là 100ml. Tính nồng độ mol của các chất tan trong dung dịch
A. [Na[Al(OH)4]] = 0,2M; [NaOH] = 0,4M
B. [Na[Al(OH)4]] = 0,2M; [NaOH] = 0,2M
C. [Na[Al(OH)4]] = 0,4M; [NaOH] = 0,2M
D. [Na[Al(OH)4]] = 0,2M
Gọi số mol Na2O và Al2O3 lần lượt là x, y
Nhận thấy khi thêm 0,1 mol HCl vào dung dịch X thì thấy xuất hiện kết tủa
→ Trong dung dịch X chứa NaAlO2 a mol và NaOH :0,1 mol
Bảo toàn nguyên tố → nNa2O = (nNaOH + nNaAlO2):2 = (0,1 + a): 2
nAl2O3 = nNaAlO2 : 2 = a:2
Ta có phương trình : [(0,1 + a): 2 ]×62 + (a:2)×102 = 19,5→ → a= 0,2 mol
CMNaOH = 0,2M, CMNaAlO2 = 0,4M
Đáp án C
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp
Na
2
O
và
Al
2
O
3
vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là A. 23,4 và 37,9 B. 5,2 và 37,9 C. 15,6 và 27,7 D. 15,6 và 55,4
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp Na 2 O và Al 2 O 3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
A. 23,4 và 37,9
B. 5,2 và 37,9
C. 15,6 và 27,7
D. 15,6 và 55,4
Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 150ml thì bắt đầu xuất hiện kết tủa, khi hết 350 ml hoặc 750 ml thì đều thu được a gam kết tủa. giá trị của m là A. 27,70. B. 30,80. C. 33,30. D. 29,25.
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 150ml thì bắt đầu xuất hiện kết tủa, khi hết 350 ml hoặc 750 ml thì đều thu được a gam kết tủa. giá trị của m là
A. 27,70.
B. 30,80.
C. 33,30.
D. 29,25.
Giải thích:
Na2O + H2O → 2NaOH (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
Vậy dung dịch X gồm: AlO2: b (mol) ; OH- , Na+
Khi hết 150ml dd HCl thì bắt đầu xuấ hiện kết tủa => nOH - dư = nHCl = 0,15 (mol)
Khi hết 350 ml hoặc 750 ml đều thu được a (gam) kết tủa
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl (3)
2HCl + Al(OH)3 → AlCl3 + H2O (4)
TH1: Hết 350 ml HCl thu được a (g) kết tủa => phản ứng chỉ xảy ra (3)
=> nH+ = 0,35 = 0,15 + a/78 (*)
TH2: Hết 750 ml HCl thu được a (g) kết tủa => phản ứng chỉ xảy ra (3), (4)
=> nH+ = 0,75 = 0,15 + 4b - 3a/78 (**)
Từ (*) và (**) => a = 15,6 và b = 0,3 (mol)
Bảo toàn điện tích đối với dd X : nNa+ = nAlO2- + nOH- = 0,3 + 0,15 = 0,45 (mol)
=> nNa2O = 0,225 (mol)
nAl2O3 = b/2 = 0,15 (mol)
=> m = 0,225.62 + 0,15. 102 = 29,25 (g)
Đáp án D
Đúng 0
Bình luận (0)
hòa tan 19,5g hỗn hợp gồm Na2O và Al2O3 vào nước thu được 500ml dd A trong suốt. Thêm dần dần dd HCl 1M vào dd A đến khi bắt đầu xuất hiện kết tủa cần 100ml dd HCl
a) Viết các pthh
b) Tính nồng độ mol các chất trong dd A





