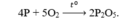Đốt Photpho trong bình chứa 43,2g O2 với H% là 48%.Tính Photpho đã đốt cháy.

Những câu hỏi liên quan
đốt cháy 12,4g photpho(P) trong bình chứa khí oxi(O2), sau p.ứng tạo ra 28,4g điphotpho pentaoxit(P2O5). Tính khối lượng khí oxi(O2) đã phản ứng?
Khối lượng khí Oxi đã phản ứng là:
mP2O5 = mP + mO2
28,4 = 12,4 + mO2
mO2 = 28,4 - 12,4
mO2 = 16 g
Đúng 0
Bình luận (0)
Oxit sinh ra khi đốt cháy một lượng nhỏ photpho đơn chất (P) trong bình chứa khí chứa
O
2
dư là A.
PO
5
.
B.
P
2
O
7
.
C.
P
2
O
3
.
D.
P
2
O
5
.
Đọc tiếp
Oxit sinh ra khi đốt cháy một lượng nhỏ photpho đơn chất (P) trong bình chứa khí chứa O 2 dư là
A. PO 5 .
B. P 2 O 7 .
C. P 2 O 3 .
D. P 2 O 5 .
Đốt cháy hoàn toàn 3,1 g Photpho trong bình chứa khí O2 . Sản phẩm thu được là điphotpho pentaoxit.
a. Hãy viết phương trình phản ứng xảy ra.
b. Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng trên.
c. Tính khối lượng của chất được tạo thành.
Giải rồi cho mình công thức của mấy bài như vậy với ạ. Mình cảm ơn
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -t°-> 2P2O5
0,1---> 0,125--->0,05
VO2 = 0,125 . 22,4 = 2,8 (l)
mP2O5 = 0,05 . 142 = 7,1 (g)
Đúng 3
Bình luận (1)
\(n_P=\dfrac{3,1}{31}=0,1mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,1 0,125 0,05
\(V_{O_2}=0,125\cdot22,4=2,8l\)
\(m_{P_2O_5}=0,05\cdot142=7,1g\)
Đúng 3
Bình luận (1)
a,PTHH : \(4P+5O_2->2P_2O_5\)
b,
Số mol O2 tham gia phản ứng :
nO2 = 5/4.nP = 5/4 . 0,1 = 0,125 ( mol )
=> V O2 phản ứng : 0,125 . 22,4 = 2,8 ( lít )
c,
Số mol P2O5 : np2o5 = 1/2.np = 0,05 ( mol )
=> m = 142 . 0,05 = 7,1 (g)
Đúng 2
Bình luận (1)
Câu 5. Đốt cháy photpho trong bình chứa 11,2 lít khí O2 thu được điphotpho pentaoxit (P2O5). a/ Lập phương trình hóa học của phản ứng trên. b/ Tính khối lượng của photpho cần dùng trong phản ứng. c/ Nếu có 24,8 g photpho tham gia phản ứng với lượng khí O2 trên.Hãy tính khối lượng điphotpho pentaoxit tạo thành.
Đọc tiếp
Câu 5. Đốt cháy photpho trong bình chứa 11,2 lít khí O2 thu được điphotpho pentaoxit (P2O5).
a/ Lập phương trình hóa học của phản ứng trên.
b/ Tính khối lượng của photpho cần dùng trong phản ứng.
c/ Nếu có 24,8 g photpho tham gia phản ứng với lượng khí O2 trên.Hãy tính khối lượng điphotpho pentaoxit tạo thành.
\(a.PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(b.n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(\Rightarrow n_P=\dfrac{0,5}{5}.4=0,4\left(mol\right)\\ \Rightarrow m_P=0,4.31=12,4\left(g\right)\)
\(m_{O_2}=0,5.32=16\left(g\right)\\ \Rightarrow m_P+m_{O_2}=m_{P_2O_5}\\ m_{P_2O_5}=24,8+16=40,8\left(g\right)\)
Đúng 3
Bình luận (0)
a) \(PTHH:4P+5O_2\) → \(2P_2O_5\)
b) \(n_{O_2}=\dfrac{V_{O_2\left(đktc\right)}}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PTHH:
⇒ \(n_P=\dfrac{4}{5}.n_{O_2}=\dfrac{4}{5}.0,5=0,4\left(mol\right)\)
⇒ \(m_P=n.M=0,4.31=12,4\left(g\right)\)
c) Theo định luật bảo toàn khối lượng
⇒ \(m_P+m_{O_2}=m_{P_2O_5}\)
⇒ \(m_{P_2O_5}=?\)
Đúng 0
Bình luận (1)
a) 4P + 5O2 -> 2P2O5
0,4mol<-0,5mol->0,2mol(1)
0,8mol ->0,4mol(2)
nO2=11,2/22,4=0,5mol
nP=24,8/31=0,8mol
b)mP=0,4x31=12,4g
c)mP2O5=0,4x142=56,8
Đúng 0
Bình luận (0)
Đốt cháy 7,44 gam photpho trong bình chứa 6,16 lít khí O 2 (đktc) tạo ra ddiphotpho pentaoxit. Tính khối lượng chất còn dư sau phản ứng.
Đốt cháy 6, 2 g photpho trong một bình có chứa 6, 72 lít khí O2 (ởđktc).a) Viết phương trình phản ứng xảy ra.b) Sau phản ứng photpho hay oxi dư?Số mol chất dư là bao nhiêu?c) Tính khối lượng hợp chất tạo thành
\(n_P = \dfrac{6,2}{31} = 0,2(mol)\\ n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ \dfrac{n_P}{4} = 0,05 < \dfrac{n_{O_2}}{5} = 0,06\)
Do đó : O2 dư.
4P + 5O2 \(\xrightarrow{t^o} \) 2P2O5
0,2..............0,25..................0,1..................(mol)
\(n_{O_2\ dư} = 0,3 - 0,25 = 0,05(mol)\)
\(m_{P_2O_5} = 0,1.142 = 14,2(gam)\)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 12,4g photpho trong bình chứa không khí
a) viết phương trình hóa học
b) tính thể tích khí O2 cần dùng để đốt cháy hoàn toàn lượng phopho trên
c) tính thể tích không khí cần dùng để đốt cháy biết oxi chiếm 1/5 thể tích không khí
4P+5O2-to>2P2O5
0,4---0,5-----0,2
n P=0,4 mol
=>VO2=0,5.22,4=11,2l
=>Vkk=1,12.5=5,6l
Đúng 2
Bình luận (0)
Câu 1:Đốt cháy 12,4 gam photpho trong bình chứa khí oxi tạo thành điphotpho pentaoxit (chất rắn, màutrắng). Tính khối lượng chất rắn tạo thành sau phản ứng.
Câu 2:Đốt cháy 12,4 gam photpho trong bình chứa 5,6 lít khí oxi (đktc) tạo thành điphotpho pentaoxit (chất rắn, màu trắng). Tính khối lượng chất rắn tạo thành sau phản ứng.
Câu 1 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,2
\(n_{P2O5}=\dfrac{0,4.2}{4}=0,2\left(mol\right)\)
⇒ \(m_{P2O5}=0,2.142=28,4\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Câu 2 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O2\left(dktc\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,25 0,1
Lập tỉ số só sánh : \(\dfrac{0,4}{4}>\dfrac{0,25}{5}\)
⇒ P dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
\(n_{P2O5}=\dfrac{0,25.2}{5}=0,1\left(mol\right)\)
⇒ \(m_{P2O5}=0,1.142=14,2\left(g\right)\)
\(n_{P\left(dư\right)}=0,4-\left(\dfrac{0,25.4}{5}\right)=0,2\left(mol\right)\)
⇒ \(m_{P\left(dư\right)}=0,2.31=6,2\left(g\right)\)
\(m_{rắn}=14,2+6,2=20,4\left(g\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam photpho trong khí O2 lấy dư thu được 7,1g photpho (V) oxit a) Viết PTPƯ xảy ra b) tính khối lượng photpho và thể tích oxi đã phản ứng c) nếu sau lư, O2 còn dư 15% so với lượng pư thì thể tích O2 đem dùng ở đktc là bao nhiêu lít?
a, PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, Ta có: \(n_{P_2O_5}=\dfrac{7,1}{142}=0,05\left(mol\right)\)
Theo PT: \(n_P=2n_{P_2O_5}=0,1\left(mol\right)\)
\(\Rightarrow m_P=0,1.31=3,1\left(g\right)\)
\(n_{O_2}=\dfrac{5}{2}n_{P_2O_5}=0,125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,125.22,4=2,8\left(l\right)\)
c, Có: \(V_{O_2\left(dư\right)}=2,8.15\%=0,42\left(l\right)\)
\(\Rightarrow V_{O_2}=2,8+0,42=3,22\left(l\right)\)
Đúng 1
Bình luận (0)