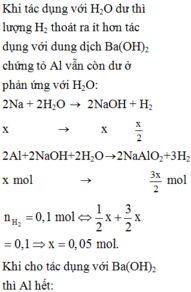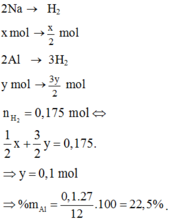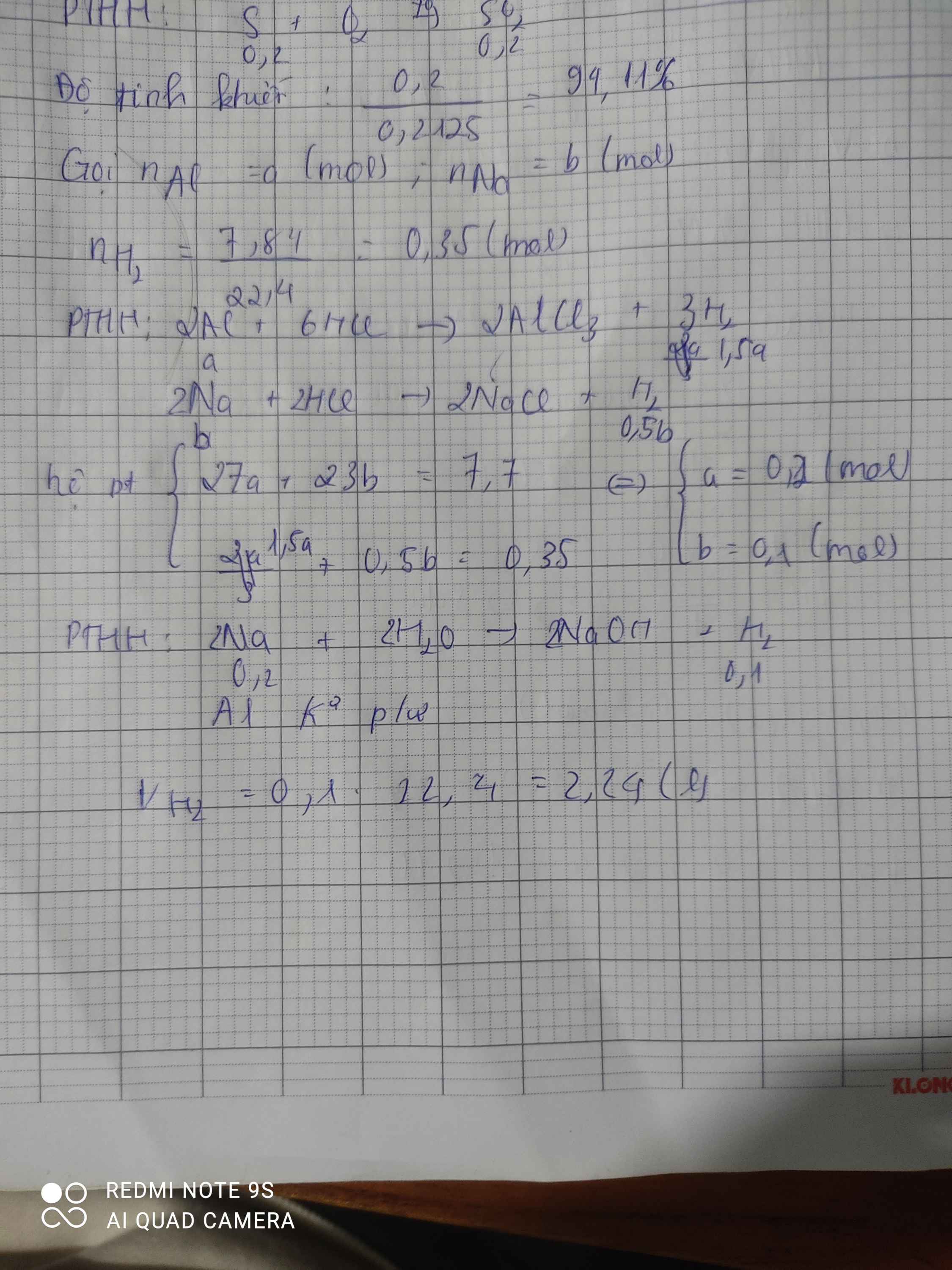Cho m gam hỗn hợp ( Na, Al ) vào nước dư thấy thoát ra 8,96 lít khí đktc và còn lại 2,7g kim loại không tan.Khối lượng m của hỗn hợp ban đầu là ?

Những câu hỏi liên quan
Cho 18,0 gam hỗn hợp gồm Na và Al vào nước dư, thấy thoát ra 5,376 lít khí khí H2 (đktc) và còn lại m gam rắn không tan. Giá trị m là
A. 16.
B. 12.
C. 10
D. 8.
A là hỗn hợp của Na, Mg, Al
- Cho a gam A vào nước dư phản ứng xong thoát ra 4,48 lít khí H2
- Cho a gam A vào dung dịch Ba(OH)2 dư thấy thoát ra 7,84 lít khí H2
- Cho a gam A vào dung dịch H2SO4 dư thoát ra 11,2 lít khí H2
Hãy tính a và phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu( biết thể tích các khí đo ở ĐKTC)
HD:
Thí nghiệm 1 chỉ có Na phản ứng:
Na + HOH \(\rightarrow\) NaOH + 1/2H2 (1)
0,4 0,2 mol
Thí nghiệm 2 chỉ có Al phản ứng (kim loại lưỡng tính):
Al + OH- + H2O \(\rightarrow\) AlO2- + 3/2H2 (2)
0,7/3 0,35 mol
Thí nghiệm 3 cả 3 chất đều phản ứng:
2Na + H2SO4 \(\rightarrow\) Na2SO4 + H2 (3)
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2 (4)
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (5)
Gọi x, y, z tương ứng là số mol của Na, Mg và Al trong a gam hh.
Ta có: x = 0,4 mol; z = 0,7/3 mol; x/2 + y + 3z/2 = 0,5. Suy ra: y = -0.5 < 0 (vô lí)
Bạn xem lại đề bài, đề bài ko đúng.
Đúng 0
Bình luận (0)
Do ở thí nghiệm 2 nH2 > n H2 thí nghiệm 1 -> ở thí nghiệm 1 NaOH hết ( Nếu NaOH dư thì nH2 ở 2 thí nghiệm đầu phải bằng nhau)
gọi a là số mol na b là số mol al c là số mol mg
Thí nghiệm 1 : Na+H20 - Naoh+1/2 H2
a a a/2
Al+naoh+h20-> naal02+3/2 H2
a 3/2a (do Naoh hết)
Vậy a/2+3/2 a = 0.2-> a=0.1
Thí nghiệm 2 : Na+h20 - naoh +1/2 H2
a a/2
Al+Oh-+h20--> alo2-+3/2 H2
b 3/2 b
a/2 +3/2 b = nH2=0.35-> b=0.2
Thí nghiệm 3: nH2 =0.5 = a/2+3/2b+c--> c =0.15
Vậy hh A gồm 0.1 Na 0.2 Al 0.15 Mg
Đúng 0
Bình luận (0)
Cho 10 gam hỗn hợp kim loại gồm Fe, Cr và Al tác dụng với lượng dư dung dịch NaOH thấy thu được 0,672 lít khí ở đktc. Lấy phần chất rắn còn lại tác dụng với lượng dư HCl (khi không có không khí) thu được 3,808 lít khí ở đktc. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
cho m gam hỗn hợp Fe và Cu tác dụng với lượng dư dung dịch axit H2S04 loãng thì thu được 8,96 lít khí (đktc) .Sau phản ứng thấy còn 5 g chất rắn không tan .Tính thành phần % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,4 0,4
\(m_{Fe}=0,4.56=22,4\left(g\right)\)
\(m_{hh}=22,4+5=27,4\left(g\right)\)
\(\%m_{Fe}=\dfrac{22,4.100\%}{27,4}=81,75\%;\%m_{Cu}=100-81,75=18,25\%\)
Đúng 1
Bình luận (0)
Hỗn hợp A gồm Na, Al, Cu. Cho 12 gam A vào nước dư thu 2,24 lít khí (đktc), còn nếu cho vào dung dịch NaOH dư thu 3,92 lít khí (đktc). Phần trăm về khối lượng của Al trong hỗn hợp ban đầu là: A. 59,06%. B. 22,5%. C. 67,5%. D. 96,25%.
Đọc tiếp
Hỗn hợp A gồm Na, Al, Cu. Cho 12 gam A vào nước dư thu 2,24 lít khí (đktc), còn nếu cho vào dung dịch NaOH dư thu 3,92 lít khí (đktc). Phần trăm về khối lượng của Al trong hỗn hợp ban đầu là:
A. 59,06%.
B. 22,5%.
C. 67,5%.
D. 96,25%.
Hòa tan hoàn toàn 7,7g hỗn hợp gồm hai kim loại Al và Na bằng dung dịch HCl dư thấy thoát ra 7,84 lít khí H2 (ở đktc). Tính thể tích khí H2 thu được khi cho hỗn hợp trên vào lượng nước dư
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là A. 7,7. B. 7,3. C. 5,0. D. 6,55.
Đọc tiếp
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
A. 7,7.
B. 7,3.
C. 5,0.
D. 6,55.
Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam
Đúng 0
Bình luận (0)
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là A. 7,7 B. 7,3 C. 5,0 D. 6,55
Đọc tiếp
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
A. 7,7
B. 7,3
C. 5,0
D. 6,55
Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư
⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2)
⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam
Đúng 0
Bình luận (0)
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
A. 7,7.
B. 7,3.
C. 5,0.
D. 6,55.
Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam
Đúng 0
Bình luận (0)