Khối lương nguuên tử cuả vàng là bao nhiêu

Những câu hỏi liên quan
Khối lương nguyê tử của vàng là bao nhiêu
Khối lương nguyên tử của vàng là 79
bn có thể dò trong BTH
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Nguyên tử canxi có khối lượng riêng bằng 1,55g/cm3, nguyên tử khối của canxi là 40u biết độ đặc khít là 74%. Tính b k nguyên tử canxi theo A°
Giả sử ta có 1 mol Ca ---> mCa = 40 gam.
=> 1 mol Ca có thể tích V = 40/1,55 = 25,8065 (cm3).
Vì độ đặc khít là 74% => V thực tế = 25,8065 . 74/100 = 19,097 (cm3).
=> 1 nguyên tử Ca chiếm thể tích = 19,097/ NA
= 19,097/(6,023. 10^23) = 3,17.10^-23 (cm3).
mà
=> r = 1,963.10^-8 cm
=> r = 0,1963 nm.= 1,963 Ao
Đúng 0
Bình luận (0)
Một lượng khí có khối lượng là 30 kg và chứa
11
,
28
.
10
26
phân tử. Phân tử khí này gồm các nguyên tử hiđrô và cacbon. Biết 1 mol khí có
N
A
6
,
02
.
10
23
phân tử. Khối lượng của các nguyển tử cacbon và hiđrô trong khí này là A....
Đọc tiếp
Một lượng khí có khối lượng là 30 kg và chứa 11 , 28 . 10 26 phân tử. Phân tử khí này gồm các nguyên tử hiđrô và cacbon. Biết 1 mol khí có N A = 6 , 02 . 10 23 phân tử. Khối lượng của các nguyển tử cacbon và hiđrô trong khí này là
A. m C = 2 . 10 - 26 k g ; m H = 0 , 66 . 10 - 26 k g
B. m C = 4 . 10 - 26 k g ; m H = 1 , 32 . 10 - 26 k g
C. m C = 2 . 10 - 6 k g ; m H = 0 , 66 . 10 - 6 k g
D. m C = 4 . 10 - 6 k g ; m H = 1 , 32 . 10 - 6 k g
Chọn A.
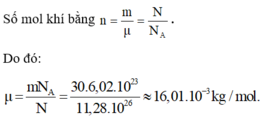
Trong khi có hiđrô và cacbon, chí CH4 có
μ = (12 + 4).10-3 kg/mol
Vì thế, khí đã cho là CH4. Khối lượng của 1 phân tử khí CH4 là 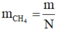
Khối lượng của nguyên tử hiđrô là:
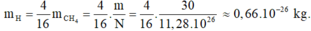
Khối lượng của nguyên tử cacbon là:
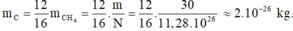
Đúng 0
Bình luận (0)
Một lượng khí có khối lượng là 30 kg và chứa
11
,
28
.
10
26
phân tử. Phân tử khí này gồm các nguyên tử hiđrô và cacbon. Biết 1 mol khí có
N
A
6
,
02
.
10
23
phân tử. Khối lượng của các nguyển tử cacbon và hiđrô trong khí này là A.
m...
Đọc tiếp
Một lượng khí có khối lượng là 30 kg và chứa 11 , 28 . 10 26 phân tử. Phân tử khí này gồm các nguyên tử hiđrô và cacbon. Biết 1 mol khí có N A = 6 , 02 . 10 23 phân tử. Khối lượng của các nguyển tử cacbon và hiđrô trong khí này là
A. m C = 2 . 10 - 26 k g ; m H = 0 , 66 . 10 - 26 k g
B. m C = 4 . 10 - 26 k g ; m H = 1 , 32 . 10 - 26 k g
C. m C = 2 . 10 - 6 k g ; m H = 0 , 66 . 10 - 6 k g
D. m C = 4 . 10 - 6 k g ; m H = 1 , 32 . 10 - 6 k g
Chọn A.
Số mol khí bằng
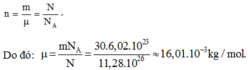
Trong khi có hiđrô và cacbon, chí CH4 có μ = (12 + 4).10-3 kg/mol
Vì thế, khí đã cho là CH4. Khối lượng của 1 phân tử khí CH4 là
![]()
Khối lượng của nguyên tử hiđrô là:
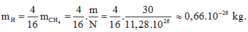
Khối lượng của nguyên tử cacbon là:
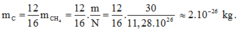
Đúng 0
Bình luận (0)
Đơn chất Brôm có phân tử khối là 160, đơn chất Clo có phân tử khối là 71. Hãy tính số nguyên tử Brôm, Clo trong một phân tử chất đó
Xem chi tiết
Ta có nguyên tử khối của:
M Br= 80 => 1 phân tử Brom có 160/80 = 2 ng tử
tương tự M Cl= 35,5 => 1 ph tử Clo có 2 ng tử
Đúng 0
Bình luận (0)
Bán kính nguyên tử fe là 1,28 A°, khối lượng mol nguyên fe 56g/mol. Tính khối lượng riêng của nguyên tử fe biết độ đặc khít là 73%
Biết khối lượng của 1 mol nước là
m
18
.
10
-
3
k
g
và 1 mol có
N
A
6
,
02
.
10
23
phân tử. Biết khối lượng riêng của nước là
m
10
3...
Đọc tiếp
Biết khối lượng của 1 mol nước là m = 18 . 10 - 3 k g và 1 mol có N A = 6 , 02 . 10 23 phân tử. Biết khối lượng riêng của nước là m = 10 3 k g / m 3 . Số phân tử có trong 300 c m 3 là
A. 6 , 7 . 10 24 p h â n t ử .
B. 10 , 03 . 10 24 p h â n t ử .
C. 6 , 7 . 10 23 p h â n t ử .
D. 10 , 03 . 10 23 p h â n t ử .
Chọn B.
Trong 1 mol khí có NA = 6,02.1023 nguyên tử (hoặc phân tử).
Khối lượng của nước là m = ρV
Khối lượng của 1 phân tử nước là m0 = μ/NA.
Số phân tử nước bằng
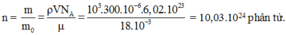
Đúng 0
Bình luận (0)
Biết khối lượng của 1 mol nước là
μ
18
.
10
-
3
kg và 1 mol có
N
A
6
,
02
.
10
23
phân tử. Biết khối lượng riêng của nước là ρ
10
3
k
g
/
m
3
. Số phân t...
Đọc tiếp
Biết khối lượng của 1 mol nước là μ = 18 . 10 - 3 kg và 1 mol có N A = 6 , 02 . 10 23 phân tử. Biết khối lượng riêng của nước là ρ = 10 3 k g / m 3 . Số phân tử có trong 300 c m 3 là
A. 6 , 7 . 10 24 phân tử
B. 10 , 03 . 10 24 phân tử
C. 6 , 7 . 10 23 phân tử
D. 10 , 03 . 10 23 phân tử
Chọn B.
Trong 1 mol khí có N A = 6 , 02 . 10 23 nguyên tử (hoặc phân tử).
Khối lượng của nước là m = ρV
Khối lượng của 1 phân tử nước là m0 = μ / N A .
Số phân tử nước bằng:
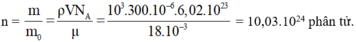
Đúng 0
Bình luận (0)
Một hợp chất A có khối lượng mol phân tử là 58,5g/mol thành phần các nguyên tố theo khối lượng 39,32% Na và còn lại là Cl xác định công thức phân tử của hợp chất
%Cl = 100% - 39,32% = 60,68%
Gọi CTHH của A là $Na_xCl_y$
Ta có :
$\dfrac{23x}{39,32} = \dfrac{35,5y}{60,68} = \dfrac{58,5}{100}$
Suy ra : $x = 1 ; y = 1$
Vậy CTHH của hợp chất là NaCl
Đúng 4
Bình luận (0)
\(m_{Na}=\%Na.M_A=39,32\%.58,5=23\left(g\right)\\ m_{Cl}=m_A-m_{Na}=58,5-23=35,5\left(g\right)\\ \Rightarrow n_{Na}=\dfrac{23}{23}=1\left(mol\right)\\ n_{Cl}=\dfrac{35,5}{35,5}=1\left(mol\right)\\ CTHH:NaCl\)
Đúng 1
Bình luận (0)
%Cl = 100% - 39,32% = 60,68%
Gọi CTHH của A là $Na_xCl_y$
Ta có :
$\dfrac{23x}{39,32} = \dfrac{35,5y}{60,68} = \dfrac{58,5}{100}$
Suy ra : $x = 1 ; y = 1$
Vậy CTHH của hợp chất là NaCl
Đúng 0
Bình luận (1)
Xem thêm câu trả lời















