Nêu phương pháp và vẽ hình mô tả quá trình điều chế khí clo trong phòng thí nghiệm? Viết phương trình hóa học minh họa và giải thích quá trình để thu được khí clo tinh khiết.

Những câu hỏi liên quan
Trong phòng thí nghiệm có các hóa chất KClO3 , MnO2 và dụng cụ cần thiết
a, Viết phương trình hóa học của phản ứng điều chế khí oxi
b, Hãy vẽ hình mô tả thí nghiệm điều chế và thu khí oxi bằng cách đẩy không khí
a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK
Đúng 0
Bình luận (1)
Trong phòng thí nghiệm, quá trình điều chế khí Z thường bị lẫn SO2. Để loại bỏ SO2 ra khỏi hỗn hợp khí gồm Z và SO2, có thể dùng dung dịch chứa chất nào trong các chất ( riêng biệt) sau đây: BaCl2, Ca(OH)2, Br2 và K2SO3? Giải thích và viết phương trình hóa học minh họa cho các phản ứng.
Trong phòng thí nghiệm, quá trình điều chế khí Z thường bị lẫn SO2 nên Z là C2H4.
Vậy để tách SO2 ra khỏi hỗn hợp C2H4 và SO2 ta có thể dùng các chất: Ca(OH)2, K2SO3.
PTHH:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
K2SO3 + SO2 + H2O → 2KHSO3
Đúng 0
Bình luận (0)
Cho hình vẽ sau: a. Nếu khí Y là khí oxi thì hình nào trên đây mô tả đúng sự điều chế oxi trong phòng thí nghiệm? Giải thích sự lựa chọn này. b. Viết hai phương trình hóa học điều chế khí oxi trong phòng thí nghiệm từ hai chất rắn X khác nhau.
Đọc tiếp
Cho hình vẽ sau:
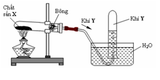
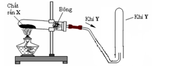
a. Nếu khí Y là khí oxi thì hình nào trên đây mô tả đúng sự điều chế oxi trong phòng thí nghiệm? Giải thích sự lựa chọn này.
b. Viết hai phương trình hóa học điều chế khí oxi trong phòng thí nghiệm từ hai chất rắn X khác nhau.
a. Khí O2 ít tan trong nước và nặng hơn không khí nên cách 1b không được (khi đó không khí sẽ xua hết khí O2 ra ngoài), trong phòng thí nghiệm người ta sử dụng cách 1a
b. Điều chế khí O2 người ta nhiệt phân các hợp chất giàu oxi: KMnO4; KClO3
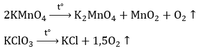
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, 3 khí X, Y, Z được điều chế và thu như hình vẽ dưới đây: Viết phương trình hóa học điều chế các khí trên.
Đọc tiếp
Trong phòng thí nghiệm, 3 khí X, Y, Z được điều chế và thu như hình vẽ dưới đây:
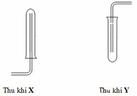

Viết phương trình hóa học điều chế các khí trên.
Chọn X: H2 ; Y : O2 ; Z: C2H2
Zn + 2HCl → ZnCl2 + H2
2KMnO4 →K2MnO4 + MnO2 + O2
CaC2 + 2H2O → Ca(OH)2 + C2H2
Đúng 0
Bình luận (0)
Hiđro clorua ( hcl ) là một chất khí được dùng để sản xuất axit clohiđric ( 1 trong các axit được dùng phổ biến trong phòng thí nghiệm ) . trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo ( ở đktc ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở đktc ) và khối lượng khí Hiđro clorua thu được sau phản ứng . Nêu nêu các bước giải bài toán tính theo phương trình hóa học .
Đọc tiếp
Hiđro clorua ( hcl ) là một chất khí được dùng để sản xuất axit clohiđric ( 1 trong các axit được dùng phổ biến trong phòng thí nghiệm ) . trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo ( ở đktc ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở đktc ) và khối lượng khí Hiđro clorua thu được sau phản ứng .
Nêu nêu các bước giải bài toán tính theo phương trình hóa học .
1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)
Đúng 0
Bình luận (0)
Hình dưới đây mô tả thí nghiệm điều chế khí Z. Khí Z có thể là khí nào trong số các khí sau: H2, NH3, SO2, CO2. Viết phương trình hóa học minh họa và chỉ rõ các chất X, Y trong phản ứng.
Đọc tiếp
Hình dưới đây mô tả thí nghiệm điều chế khí Z. Khí Z có thể là khí nào trong số các khí sau: H2, NH3, SO2, CO2. Viết phương trình hóa học minh họa và chỉ rõ các chất X, Y trong phản ứng.
Z có thể là $H_2$
X : $H_2SO_4$
Y : $Mg$
PTHH :
$Mg + H_2SO_4 \to MgSO_4 + H_2$
Đúng 4
Bình luận (0)
Trong phòng thí nghiệm, bộ dung cụ điều chế và thu khí SO2 được lắp như sau:
a/ Khí SO2 được thu bằng phương pháp nào? Giải thích cách đặt bình thu khí.
b/ Xác định dung dịch X, chất rắn Y và dung dịch Z. Viết phương trình hóa học của phản ứng xảy ra giữa X và Y.
c/ Nêu vai trò của bông tẩm dung dịch Z. Viết 1 phương trình hóa học minh họa.
d/ Kể tên 3 hóa chất có thể làm khô khí SO2.
Đọc tiếp
Trong phòng thí nghiệm, bộ dung cụ điều chế và thu khí SO2 được lắp như sau: a/ Khí SO2 được thu bằng phương pháp nào? Giải thích cách đặt bình thu khí. b/ Xác định dung dịch X, chất rắn Y và dung dịch Z. Viết phương trình hóa học của phản ứng xảy ra giữa X và Y. c/ Nêu vai trò của bông tẩm dung dịch Z. Viết 1 phương trình hóa học minh họa. d/ Kể tên 3 hóa chất có thể làm khô khí SO2.
Cho hình vẽ mô tả quá trình điều chế khí Z trong phòng thí nghiệm : Z là khí nào ? A. NH3 B. CO2 C. SO2 D. Cl2
Đọc tiếp
Cho hình vẽ mô tả quá trình điều chế khí Z trong phòng thí nghiệm :
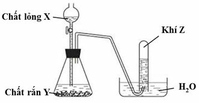
Z là khí nào ?
A. NH3
B. CO2
C. SO2
D. Cl2
Cho hình vẽ mô tả quá trình điều chế khí Z trong phòng thí nghiệm :Z là khí nào ? A. NH3. B. CO2. C. SO2. D. Cl2.
Đọc tiếp
Cho hình vẽ mô tả quá trình điều chế khí Z trong phòng thí nghiệm :
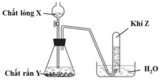
Z là khí nào ?
A. NH3.
B. CO2.
C. SO2.
D. Cl2.
Đáp án B
Các khí NH 3 , SO 2 , Cl 2 không thu được bằng phương pháp đẩy nước vì : NH 3 tan rất nhiều trong nước; SO 2 và Cl 2 vừa có khả năng phản ứng với nước và vừa tan trong nước.
Khí CO 2 ít tan trong nước nên có thể thu được bằng cách đẩy nước. Vậy X là CO 2
Đúng 0
Bình luận (0)











