Hỗn hợp khi A gồm oxi và ozon có thể tích đo ở dktc là 8.96 lít. Hỗn hợp khí này có tỉ khối đối với H2 bằng 20. Hãy xác định thể tích từng khí trong hh A

Những câu hỏi liên quan
1) Có một hỗn hợp khí gồm oxi và ozon. Hỗn hợp khí này có tỉ khối đối vs hidro là 18. Hãy xác đimhj thành phần phần trăm theo thể tích của hỗn hợp khí2) Hỗn hợp khí A gồm O2 và O3, tỉ khối hơi của hỗn hợp khí A và khí H2 là 19,2. Hỗn hợp khí B gồm có H2 và CO, tỉ khối của hh khí B đối vs H2 là 3,6.@a) Tính thành phần % theo thể tích của mỗi khí có trong hh khí A và Bb) Một mol khí A có thể đốt cháy hoàn toàn bao nhiêu mol khí COGiải theo pp tăng giảm khối lượng hoặc phương pháp trung bình
Đọc tiếp
1) Có một hỗn hợp khí gồm oxi và ozon. Hỗn hợp khí này có tỉ khối đối vs hidro là 18. Hãy xác đimhj thành phần phần trăm theo thể tích của hỗn hợp khí
2) Hỗn hợp khí A gồm O2 và O3, tỉ khối hơi của hỗn hợp khí A và khí H2 là 19,2. Hỗn hợp khí B gồm có H2 và CO, tỉ khối của hh khí B đối vs H2 là 3,6.
@
a) Tính thành phần % theo thể tích của mỗi khí có trong hh khí A và B
b) Một mol khí A có thể đốt cháy hoàn toàn bao nhiêu mol khí CO
Giải theo pp tăng giảm khối lượng hoặc phương pháp trung bình
Có một hỗn hợp khí gồm oxi và ozon. Hỗn hợp khí này có ti khối đối với hiđro bằng 18. Hãy xác định thành phần phần trăm theo thể tích của hỗn hợp khí.
Khối lượng mol trung bình của hỗn hợp khí:
M = 18 x 2 = 36(g/mol)
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
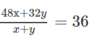
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích : Thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.
Đúng 0
Bình luận (0)
Hỗn hợp khí ozon và oxi có tỉ khối so với khí H 2 là 18. Xác định % thể tích của ozon trong hỗn hợp.
Gọi x là số mol O 3 có trong 1 mol hỗn hợp khí, số mol O 2 sẽ là (1 - x) mol.
Ta có phương trình : 48x + (1 - x).32 = 18.2
Giải ra x = 0,25.
Do %n = %V nên ozon chiếm 25% thể tích hỗn hợp.
Đúng 1
Bình luận (0)
2) hỗn hợp khí A gồm ozon và oxi có tỉ khối hơi vs hiđro=19,2 a) xác định % thể tích của A b) tính khối lượng mỗi khí có trong 7,68 gam hh khí trên
\(n_{O_3} = a ; n_{O_2} = b(mol)\\ M_A = 19,2.2 = 38,4(g/mol)\\ m_{khí} = 48a + 32b = 7,68\\ n_{khí} = a + b = \dfrac{7,68}{38,4} = 0,2\\ \Rightarrow a = 0,08 ; b = 0,12\\ \%V_{O_3} = \dfrac{0,08}{0,2}.100\% = 40\% \Rightarrow \%V_{O_2} = 100\% -40\% = 60\%\\ m_{O_3} = 0,08.48 = 3,84(gam) ; m_{O_2} = 0,12.32 = 3,84(gam)\)
Đúng 0
Bình luận (0)
4) hỗn hợp X gồm ozon và oxi có tỉ khối hơi so vs hiđro=18 a) xác định % khối lượng các khí trong X b) tính thể tích mỗi khí có trong 2,88 gam hh khí trên
\(a)n_{O_3} = a ; n_{O_2} = b\\ M_X = 18.2 = 36(g/mol)\\ \text{Ta có : } 48a + 32b = 36(a + b)\\ \Leftrightarrow 12a = 4b \Leftrightarrow \dfrac{a}{b} = \dfrac{4}{12} = \dfrac{1}{3}(1)\\ \%V_{O_3} = \dfrac{1}{1+3}.100\% = 25\%\\ \%V_{O_2} = \dfrac{3}{1+3}.100\% = 75\%\\ b) m_X = 48a + 32b = 2,88(2)\\ (1)(2) \Rightarrow a = 0,02 ; b = 0,06\\ V_{O_3} = 0,02.22,4 = 0,448(lít) ; V_{O_2} = 0,06.22,4 = 1,344(lít)\)
Đúng 0
Bình luận (0)
Cho hỗn hợp A gồm H2 và N2 có tỉ khối đối với hidro là 9,125.
a/ Tính % thể tích từng khí trong hỗn hợp A.
b/ Tính thể tích ở đktc của 14,6 gam khí A.
c/ Tính khối lượng H2 cần thêm vào 6,2 gam hỗn hợp A để được hỗn hợp B có tỉ khối đối với hidro bằng 7,5.
a) Gọi số mol H2, N2 trong A là a, b
Có \(\dfrac{2a+28b}{a+b}=9,125.2=18,25\)
=> a = 0,6b
\(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{a}{a+b}.100\%=37,5\%\\\%V_{N_2}=\dfrac{b}{a+b}.100\%=62,5\%\end{matrix}\right.\)
b) \(n_A=\dfrac{14,6}{18,25}=0,8\left(mol\right)\)
c) \(n_A=\dfrac{6,2}{18,25}=\dfrac{124}{365}\left(mol\right)\)
Gọi số mol H2 cần thêm là x
Có \(\dfrac{2x+6,2}{x+\dfrac{124}{365}}=7,5.2=15\)
=> x = 0,085 (mol)
=> mH2 = 0,085.2 = 0,17(g)
Đúng 2
Bình luận (1)
1)Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi(đktc), thu được hỗn hợp khí A có tỉ khối hơi với oxi là 1,25. a) Xác định thành phần phần trăm theo thể tích các khí có trong hỗn hợp A. b) Tính m và V. Biết rằng khi dẫn hỗn hợp khí A vào bình đựng dung dịch Ca(OH)2 dư tạo thành 6g kết tủa trắng.2) Hỗn hợp khí A gồm có O2 và O3 tỉ khối hơi đối với hiđrô là 19,2. Hỗn hợp khí B gồm có H2 và CO, tỉ khối của hỗn hợp...
Đọc tiếp
1)Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi(đktc), thu được hỗn hợp khí A có tỉ khối hơi với oxi là 1,25. a) Xác định thành phần phần trăm theo thể tích các khí có trong hỗn hợp A. b) Tính m và V. Biết rằng khi dẫn hỗn hợp khí A vào bình đựng dung dịch Ca(OH)2 dư tạo thành 6g kết tủa trắng.
2) Hỗn hợp khí A gồm có O2 và O3 tỉ khối hơi đối với hiđrô là 19,2. Hỗn hợp khí B gồm có H2 và CO, tỉ khối của hỗn hợp khí B so với hidrô là 3,6. a) Tính thành phần phần trăm theo thể tích các khí trong hỗn hợp A và hỗn hợp B. b) Tính số mol hỗn hợp khí A cần dùng để đốt cháy hoàn toàn 1 mol hỗn hợp khí B. Các thể tích được đo ở cùng điều kiện nhiệt độ, áp suất.
Giải theo phương pháp tăng giảm khối lượng hoặc phương pháp trung bình
Hỗn hợp khí A gồm CO và H2. Hỗn hợp khí B gồm O2 và O3 có tỉ khối đối với H2 là 20. Để đốt cháy hoàn toàn 10V lít A cần lượng thể tích khí B là (các khí đo ở điều kiện nhiệt độ, áp suất): A. 2V lít B. 6V lít C. 4V lít D. 8V lít
Đọc tiếp
Hỗn hợp khí A gồm CO và H2. Hỗn hợp khí B gồm O2 và O3 có tỉ khối đối với H2 là 20. Để đốt cháy hoàn toàn 10V lít A cần lượng thể tích khí B là (các khí đo ở điều kiện nhiệt độ, áp suất):
A. 2V lít
B. 6V lít
C. 4V lít
D. 8V lít
Đáp án C
Để đơn giản cho quá trình tính toán, có thể coi các phản ứng xảy ra như sau:
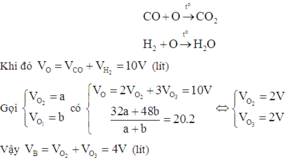
Đúng 0
Bình luận (0)
đốt cháy hoàn toàn m gam cacbon trong V lít khí Oxi (đktc) thu được hỗn hợp khí A có tỉ khối đối với oxi là 1,25
a. hãy xác định thành phần % theo thể tích các khí có trong hỗn hợp A
b. tính m và V.biết rằng khi dẫn hỗn hợp khí A vào bình đựng dunh dịch Ca(OH)2 dư tạo thành 6 gam kết tủa trắng
a)
dA/O\(_2\) = \(\dfrac{M_A}{32}\) = 1,25 \(\Rightarrow\) MA = 32 . 1,25 = 40
PTPƯ: C + O2 -----> CO2
C + CO2 -----> 2CO
Trường hợp 1 (Oxi dư)
Ta có: MA = \(\dfrac{44x+\left(1-x\right).32}{1}\) = 40 \(\Rightarrow\) x = \(\dfrac{2}{3}\)
Vậy %VCO\(_2\) = \(\dfrac{2}{3}\) . 100 = 66,67%
%VO\(_2\) = 33,33%
Trường hợp 2 (Oxi thiếu)
MA = \(\dfrac{44x+\left(1-x\right).28}{1}\) = 40 \(\Rightarrow\) x = 0,75
Vậy % VCO\(_2\) = \(\dfrac{a}{a+b}\) . 100 = \(\dfrac{3b}{4b}\) . 100 = 75%
%VCO = 25%
b)
CO2 + CA(OH)2 -----> CaOH3 \(\downarrow\) + H2O
0,06 \(\leftarrow\) 0,06 = \(\dfrac{6}{100}\)
Trường hợp 1 (nCO\(_2\) = 0,06 mol \(\Rightarrow\) nO\(_2\) dư = 0,03 mol)
Vậy mc = 0,06.12 = 0,75 (g)
VO\(_2\) = (0,06 + 0,03) . 22,4 = 2,016 (l)
Trường hợp 2 (nCO\(_2\) = 0,06 mol, nCO = \(\dfrac{1}{3}\) nCO\(_2\) = 0,02 mol)
\(\Rightarrow\) nC = nCO\(_2\) + nCO = 0,06 + 0,02 = 0,08 (mol)
\(\Rightarrow\) mC = 0,08 . 12 = 0,96 (g)
nO\(_2\) = nCO\(_2\) + \(\dfrac{1}{2}\) nCO = 0,06 + 0,01 = 0,07 (mol)
VO\(_2\) = 0,07.22,4 = 1,568 (l)
Đúng 9
Bình luận (1)











