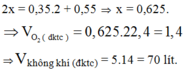Tính thể tích không khí chứa 20% Oxi(ở đktc) cần dùng để đốt cháy hoàn toàn 64 gam khí meetan?

Những câu hỏi liên quan
Câu: biết rằng Oxi chiếm 20% thể tích không khí. Đốt cháy hoàn toàn 6,4 gam Cu bằng khí oxi
a) tính thể tích không khí cần dùng (đktc)
b) tính số gam KClO3 cần dùng để điều chế lượng oxi trên ( Cho Cu=64, K=39, Cl=35,5. O=16)
a.\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,1 0,05 ( mol )
\(V_{kk}=\left(0,05.22,4\right).5=5,6l\)
b.\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
1/30 0,05 ( mol )
\(m_{KClO_3}=\dfrac{1}{30}.122,5=4,08g\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là: A. 70,0 lít B. 78,4 lít C. 84,0 lít D. 56,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là:
A. 70,0 lít
B. 78,4 lít
C. 84,0 lít
D. 56,0 lít
Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
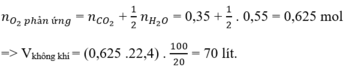
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là : A. 78,4 lít B. 56,0 lít C. 70,0 lít D. 84,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là :
A. 78,4 lít
B. 56,0 lít
C. 70,0 lít
D. 84,0 lít
Đốt cháy hoàn toàn một thể tích khí thiên nhiêm gồm: metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là A. 84,0 lít B. 70,0 lít C. 78,4 lít D. 56,0 lít
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiêm gồm: metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là
A. 84,0 lít
B. 70,0 lít
C. 78,4 lít
D. 56,0 lít
Bài 1: Đốt cháy hoàn toàn 1,3 gam C2H2 cần dùng bao nhiêu lít khí oxi ở đktc ? bao nhiêu lít (đktc) không khí chứa 20% thể tích khí oxi
\(2C_2H_2+5O_2-^{t^o}\rightarrow4CO_2+2H_2O\\ n_{C_2H_2}=\dfrac{1,3}{26}=0,05\left(mol\right)\\ n_{O_2}=\dfrac{5}{2}n_{C_2H_2}=0,125\left(mol\right)\\ \Rightarrow V_{O_2}=2,8\left(l\right)\\ Vìtrongkhôngkhíchứa20\%O_2\\ \Rightarrow V_{kk}=\dfrac{2,8}{20\%}=14\left(l\right)\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là A. 70,0 lít B. 84,0 lít C. 56,0 lít. D. 78,4 lít.
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là
A. 70,0 lít
B. 84,0 lít
C. 56,0 lít.
D. 78,4 lít.
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là: A. 70,0 lít. B. 78,4 lít. C. 84,0 lít. D. 56,0 lít.
Đọc tiếp
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là:
A. 70,0 lít.
B. 78,4 lít.
C. 84,0 lít.
D. 56,0 lít.
Câu2: Đốt cháy hoàn toàn 11,2 lit khí metan ở đktc, biết trong đó chứa 20% thể tích khí oxi. Tính thể tích không khí cần dùng.
CH4+2O2-to>CO2+2H2O
0,5-----1 mol
n CH4=\(\dfrac{11,2}{22,4}\)=0,5 mol
=>Vkk=1.22,4.5=112l
Đúng 2
Bình luận (0)
Câu 2. Đốt cháy hoàn toàn 10,8 g Nhôm trong bình chứa không khí.a) Tính thể tích khí O2 cần dùng để đốt cháy hoàn toàn lượng Nhôm ở trên.b)Tính thể tích không khí cần dùng để đốt cháy biết oxi chiếm 1/5 thể tích không khí.c) Cần bao nhiêu gam KClO3 để điều chế được lượng oxi dùng cho phản ứng trên?d) Nếu thay KMnO4 thì khối lượng KMnO4 cần là bao nhiêu ?
Đọc tiếp
Câu 2. Đốt cháy hoàn toàn 10,8 g Nhôm trong bình chứa không khí.
a) Tính thể tích khí O2 cần dùng để đốt cháy hoàn toàn lượng Nhôm ở trên.
b)Tính thể tích không khí cần dùng để đốt cháy biết oxi chiếm 1/5 thể tích không khí.
c) Cần bao nhiêu gam KClO3 để điều chế được lượng oxi dùng cho phản ứng trên?
d) Nếu thay KMnO4 thì khối lượng KMnO4 cần là bao nhiêu ?
nAl = 10,8: 27=0,4 (mol)
pthh : 4Al + 3O2 -t--->2 Al2O3
0,4---> 0,3 (mol)
=>VO2 = 0,3 .22,4 = 6,72 (l)
ta có : VO2 = 1/5 Vkk <=> Vkk = VO2 : 1/5= 33,6 (l)
pthh : 2KClO3 -t--> 2KCl + 3O2
0,2<---------------------0,3 (mol)
=> mKClO3 = 0,2 . 122,5 (g)
pthh : 2KMnO4-t--> K2MnO4 + MnO2+ O2
0,6<-------------------------------- 0,3(mol)
=> mKMnO4 = 0,6.158 = 94,8 (g)
Đúng 4
Bình luận (0)