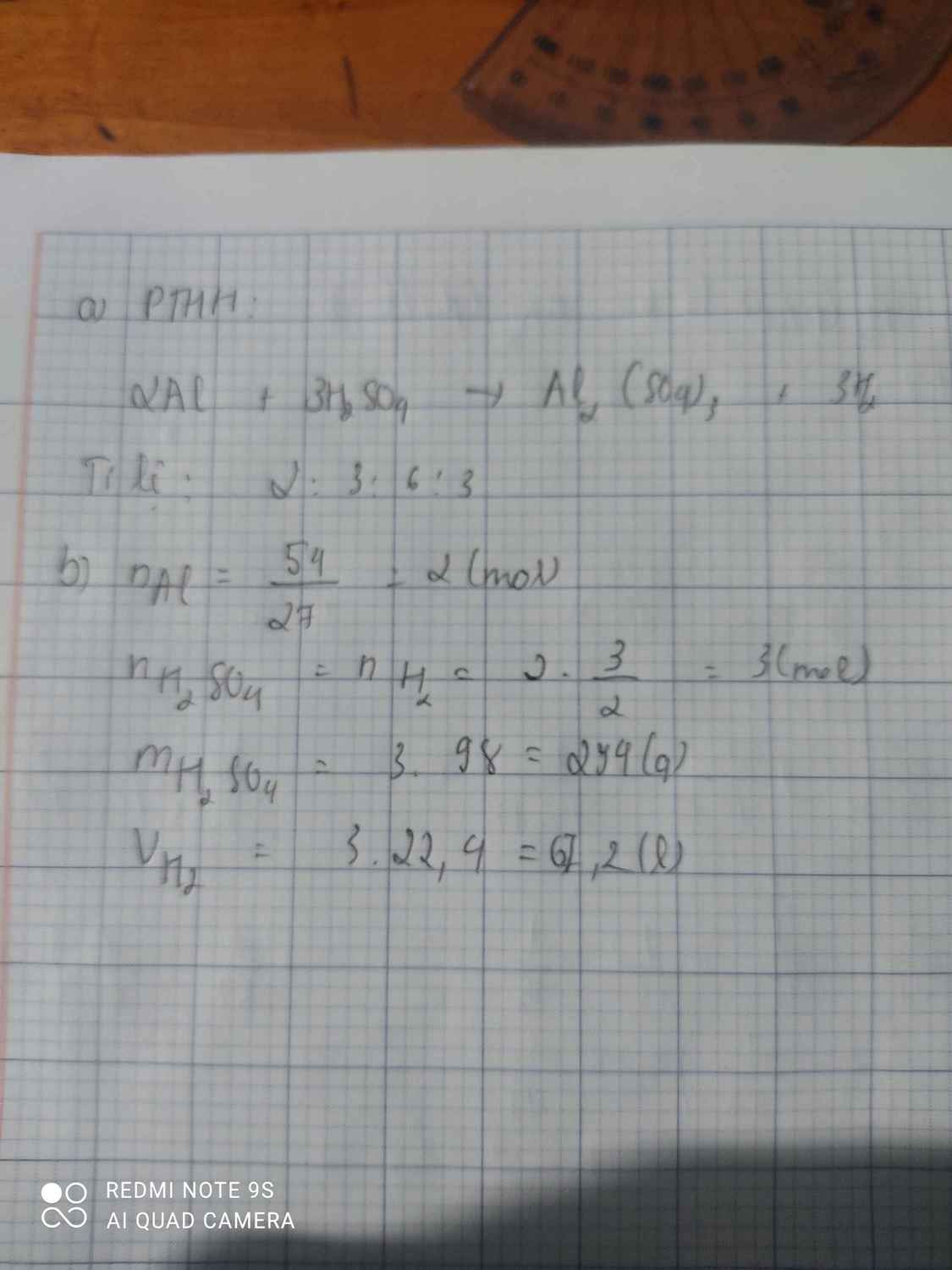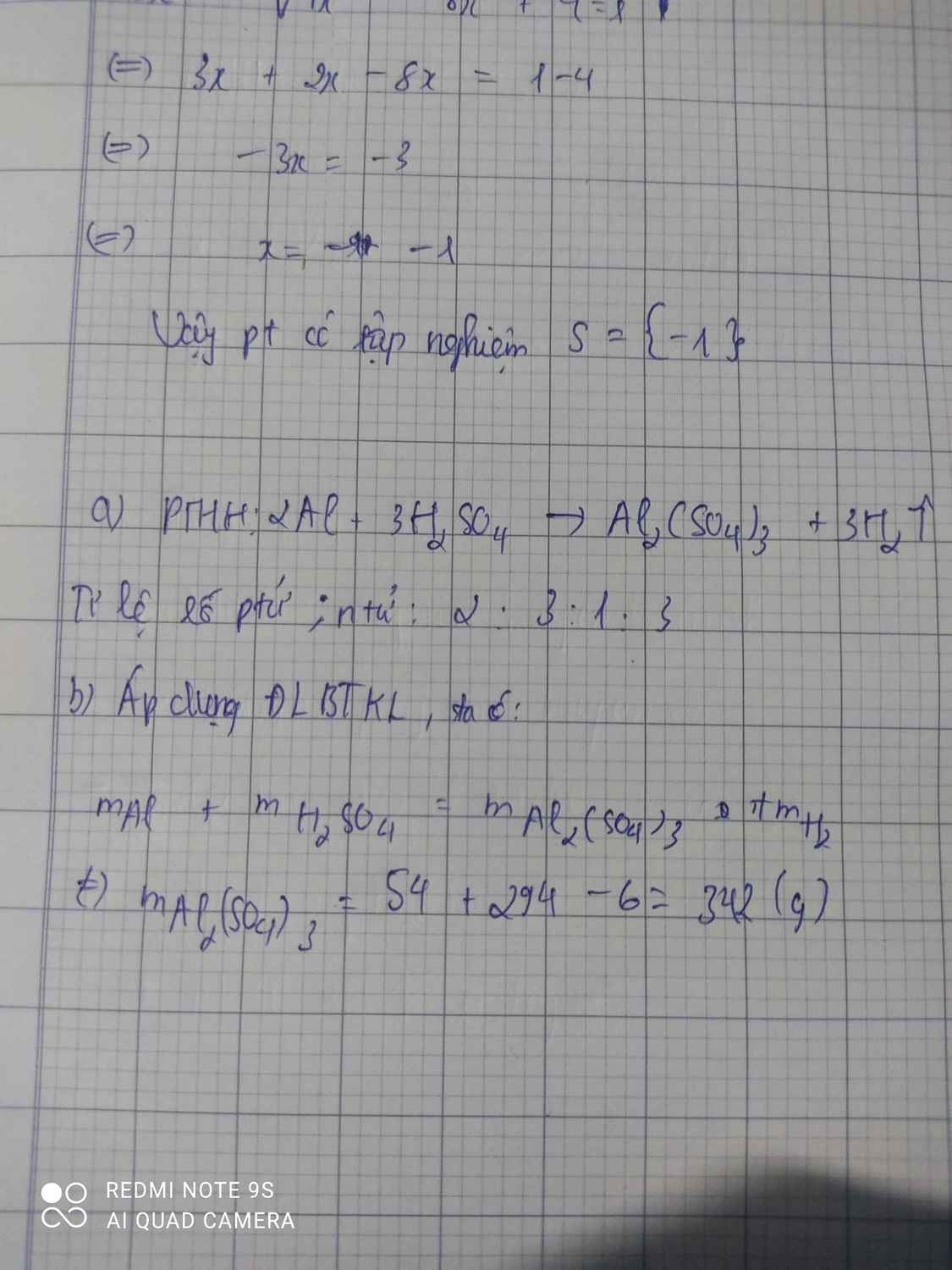Những câu hỏi liên quan
Cho m gam nhôm tác dụng với lượng dư dung dịch axit sunfuric loãng (H2SO4) thu được muối nhôm sunfat và 3,36 lít khí hiđro (đktc).
a. Viết phương trình phản ứng?
b. Tính giá trị m =?
c. Tính khối lượng muối thu được sau phản ứng?
2Al+3H2SO4->Al2(SO4)3+3H2
0,1----------------------0,075----0,15
n H2=0,15 mol
=>mAl=0,1.27=2,7g
=>m Al2(SO4)3=0,075.342=25,65g
Đúng 3
Bình luận (0)
a) PTHH: \(2Al+3H_2SO_2\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{Al}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\)
\(m_{Al}=0,1.27=2,7\left(g\right)\)
c) \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1\left(g\right)\)
Đúng 1
Bình luận (0)
2Al+3H2SO4->Al2(SO4)3+3H2
0,1----------------------0,075----0,15
n H2=0,15 mol
=>mAl=0,1.27=2,7g
=>m Al2(SO4)3=0,075.342=25,65g
Đúng 0
Bình luận (0)
Hòa tan 1 lượng nhôm vào dung dịch axit sunfuric (H2SO4) thu được 26,88 lít khí ở đktc, phản ứng theo phương trình
Al + H2SO4 - - - > Al2(SO4)3 + H2
a. Lập phương trình hóa học
b. Tính khối lượng nhôm tham gia phản ứng
c. Tính khối lượng nhôm sunfat tạo thành
a) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b) nH2 =\(\dfrac{26,88}{22,4}\)=1,2 mol
Theo tỉ lệ phản ứng => nAl phản ứng = \(\dfrac{nH_2.2}{3}\)= 0,8 mol
=> mAl phản ứng = 0,8.27= 21,6 gam
c) nAl2(SO4)3 = 1/2 nAl = 0,4 mol
=> m Al2(SO4)3 = 0,4. 342 = 136,8 gam
Đúng 1
Bình luận (0)
a) 2Al+3H2SO4⟶Al2(SO4)3+3H2↑2Al+3H2SO4⟶Al2(SO4)3+3H2↑
b) mAl=21,6gmAl=21,6g
c) mAl2(SO4)3=136,8gmAl2(SO4)3=136,8g
Giải thích các bước giải:
a) Phương trình hoá học:
2Al+3H2SO4⟶Al2(SO4)3+3H2↑2Al+3H2SO4⟶Al2(SO4)3+3H2↑
b) Số mol H2H2 sinh ra sau phản ứng:
nAl=23nH2=23⋅1,2=0,8molnAl=23nH2=23⋅1,2=0,8mol
Khối lượng AlAl tham gia phản ứng:
mAl=nAl.MAl=0,8.27=21,6gmAl=nAl.MAl=0,8.27=21,6g
c) Dựa vào phương trình hóa học ta được:
Đúng 0
Bình luận (0)
Nhôm (Al) phản ứng với axit sunfuric (H2SO4) tạo ra muối
nhôm sunfat (Al2 (SO4)3) và khí hidro.(H2)
a. Lập phương trình hóa học của phản ứng. Cho biết tỷ lệ
số nguyên tử, phân tử giữa các chất trong phản ứng.
b. Nếu dùng 54g nhôm và m g axit H2SO4 và sau phản ứng
thấy V lít khí H2 thoát ra. Tính khối lượng muối Al2 (SO4)3
thu được là bao nhiêu? Và m, V
Hòa tan hoàn toàn m g nhôm vào dung dịch axit sunfuric loãng (H2SO4). Sau phản ứng thu được nhôm sunfat (là hợp chất của nhôm và nhóm sunfat) và giải phóng 3,36 lít khí hiđro (đktc).
a) Hãy tính giá trị của m.
b) Tính khối lượng axit sunfuric đã phản ứng.
c)Tính khối lượng muối nhôm sunfat thu được sau phản ứng.
\(a,PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\\ \Rightarrow m_{Al}=0,1\cdot27=2,7\left(g\right)\\ b,n_{H_2SO_4}=n_{H_2}=0,15\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\\ c,n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2}=0,05\left(mol\right)\\ \Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05\cdot342=17,1\left(g\right)\)
Đúng 2
Bình luận (0)
Biết rằng kim loại nhôm tác dụng với axit sunfuric
H
2
S
O
4
tạo ra khi hidro H2 và chất nhôm sunfat
A
l
2
S
O
4
3
. Lập phương trình hóa học của phản ứng.
Đọc tiếp
Biết rằng kim loại nhôm tác dụng với axit sunfuric H 2 S O 4 tạo ra khi hidro H2 và chất nhôm sunfat A l 2 S O 4 3 . Lập phương trình hóa học của phản ứng.
2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
Đúng 0
Bình luận (0)
Nhôm phản ứng với H2SO4 tạo ra muối nhôm sunfat Al2 (SO4)3 và khí H2
Nếu dung 54g Nhôm và 294g H2SO4 và sau phản ứng thấy 6g khí hidro thoát ra thì khối lượng muối nhôm sunfat thu dc là bao nhiêu Al2SO4
Theo định luật bảo toàn khối lượng ta có:
\(m_{Al}+m_{H_2SO_4}=m_{Al_2\left(SO_4\right)_3}+m_{H_2}\)
=> \(m_{Al_2\left(so_4\right)_3}=\left(m_{Al}+m_{H_2SO_4}\right)-m_{H_2}\\ =>m_{Al\left(SO_4\right)_3}=\left(54+294\right)-6=342\left(g\right)\)
Đúng 0
Bình luận (0)
PTHH: 2Al + 3H2SO4 ===> Al2(SO4)3 + 3H2
Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_{Al}+m_{H2SO4}=m_{Al2\left(SO4\right)3}+m_{H2}\)
\(\Leftrightarrow m_{Al2\left(SO4\right)3}=m_{Al}+m_{H2SO4}-m_{H2}\)
\(\Leftrightarrow m_{Al2\left(SO4\right)3}=54+294-6=342\left(gam\right)\)
Vậy khối lượng nhôm sunfat thu được là 342 gam
Đúng 0
Bình luận (0)
Ta có PT:
Al + H2SO4 \(\rightarrow\) Al2(SO4)3 + H2
=> 54 + 294 = Al2(SO4)3 + 6
348 = Al2(SO4)3 + 6
Al2(SO4)3 = 342
Đúng 0
Bình luận (1)
Xem thêm câu trả lời
Cho bột nhôm vào dung dịch axit sunfuric( H2SO4) thu được muối nhôm sunfat Al2(SO4)3 và khí hiđro bay ra. a) Lập phương trình hóa học của phản ứng trên.
2Al + 3H2SO4 -> Al2(SO4)3 +3 H2
Đúng 2
Bình luận (0)
Cho 13,5g kẽm tác dụng với dung dịch có chứa 16,3gam axit sunfuric (H2SO4)Sau khi phản ứng kết thúc thu được kẽm sunfat(ZnSO4) và 0. ,3 gam khí hiđro(H2) a)viết phương trình chữ phản ứng b)tính khối lượng nhôm clorua tạo thành
Bài 26. Nhôm phản ứng với axit sunfuric (H2SO4) tạo ra muối
nhôm sunfat (Al2 (SO4)3) và khí hidro.
a. Lập phương trình hóa học của phản ứng. Cho biết tỷ lệ
số nguyên tử, phân tử giữa các chất trong phản ứng.
b. Nếu dùng 54g nhôm và 294g axit H2SO4 và sau phản ứng
thấy 6g khí H2 thoát ra thì khối lượng muối Al2 (SO4)3
thu được là bao nhiêu?