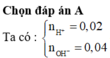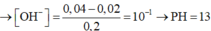Cho 100 ml dung dịch X gồm H2SO4 0,1M; HCl 0,2M; HNO3 0,3M tác dụng vừa đủ với V lít dung dịch Y chứa NaOH 0,2M và Bà(OH)2 0,1M. Tính V.

Những câu hỏi liên quan
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là: A. 13,0 B. 1,2 C. 1,0 D. 12,8
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là:
A. 13,0
B. 1,2
C. 1,0
D. 12,8
Đáp án A
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
A. 13,0
B. 1,0
C. 1,2
D. 12,8
Đáp án A
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là A. 13,0 B. 1,0 C. 1,2 D. 12,8
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
A. 13,0
B. 1,0
C. 1,2
D. 12,8
Đáp án A
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
A. 1,2
B. 1,0
C. 12,8
D. 13,0
Đáp án D
nH+ = 0,1(2. CMH2SO4 + CMHCl )= 0,02;
nNaOH = 0,1[CMNaOH + 2CMBa(OH)2] = 0,04.
H+ + OH- " H2O dư 0,02 mol OH-.
[OH-] = 0,02/(0,1+0,1) = 0,1 = 10-1.
[H+] = 10-13 ⇒ pH = 13
Đúng 0
Bình luận (0)
Đáp án D
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là: A.1,2. B.1,0. C.12,8. D.13,0.
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là:
A.1,2.
B.1,0.
C.12,8.
D.13,0.
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là A. 13,0 B. 1,0 C. 1,2 D. 12,8
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
A. 13,0
B. 1,0
C. 1,2
D. 12,8
Đáp án A
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH là A. 13,0 B. 1,2 C. 1,0 D. 12,8
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH là
A. 13,0
B. 1,2
C. 1,0
D. 12,8
Đáp án A
Ta có nH+=0.02, nOH-=0.04 nên sau phản ứng nOH- = 0,02 và V = 0,2
→ Cm OH- = 0,1 => pH = 1
Đúng 0
Bình luận (0)
Đáp án A
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH là A. 13,0. B. 1,2 C. 1,0. D. 12,8.
Đọc tiếp
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH là
A. 13,0.
B. 1,2
C. 1,0.
D. 12,8.
Chọn A
Ta có nH2SO4 = 0,05.0,1 = 0,005 mol; nHCl = 0,1.0,1 = 0,01 mol
⇒ ∑nH+ = 2nH2SO4 + nHCl = 2.0,005 + 0,01 = 0,02 mol
nNaOH = 0,2.0,1 = 0,02 mol; nBa(OH)2 = 0,1.0,1 = 0,01 mol
⇒ ∑nOH- = nNaOH + 2nBa(OH)2 = 0,02 + 2.0,01 = 0,04 mol
Khi trộn axit với kiềm thì bản chất của phản ứng là:
H+ + OH- → H2O
(0,02) (0,04)
⇒ nOH-còn dư = 0,04 – 0,02 = 0,02 mol ⇒ [OH-] còn dư = 0,02/0,2 = 0,1M
⇒ Dung dịch X có pOH = - lg[OH-]còn dư = 1 ⇒ pH = 14 – 1 = 13
Đúng 0
Bình luận (0)
Đáp án A
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch gồm Ba OH 2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H 2 SO 4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7.
B. 2
C. 1.
D. 6.
Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là A. 7 B. 2 C. 1. D. 6
Đọc tiếp
Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7
B. 2
C. 1.
D. 6
Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.
Đúng 0
Bình luận (0)