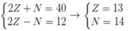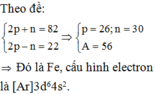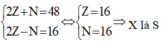Câu 1. Cho các thông tin sau:
Ion X2- có cấu hình electron: 1s22s22p63s23p6.
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA