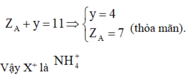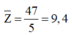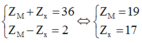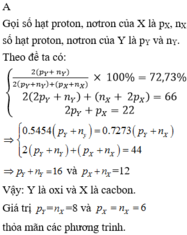Câu hỏi Hoá học:
Hợp chất M được tạo bởi ion X+ và Y2- , có tổng số proton là 70. Hai ion X+ và Y2- đều được tạo bởi 5 nguyên tử của 2 nguyên tố. Tổng số proton trong X+ là 11. Hai nguyên tố trong Y2- thuộc cùng 1 nhóm và ở hai chu kì liên tiếp trong bảng tuần hoàn. Xác định công thức hóa học của M.